Neurologie
Différencier le normal du pathologique : l’exemple des biomarqueurs du LCR pour la maladie d’Alzheimer
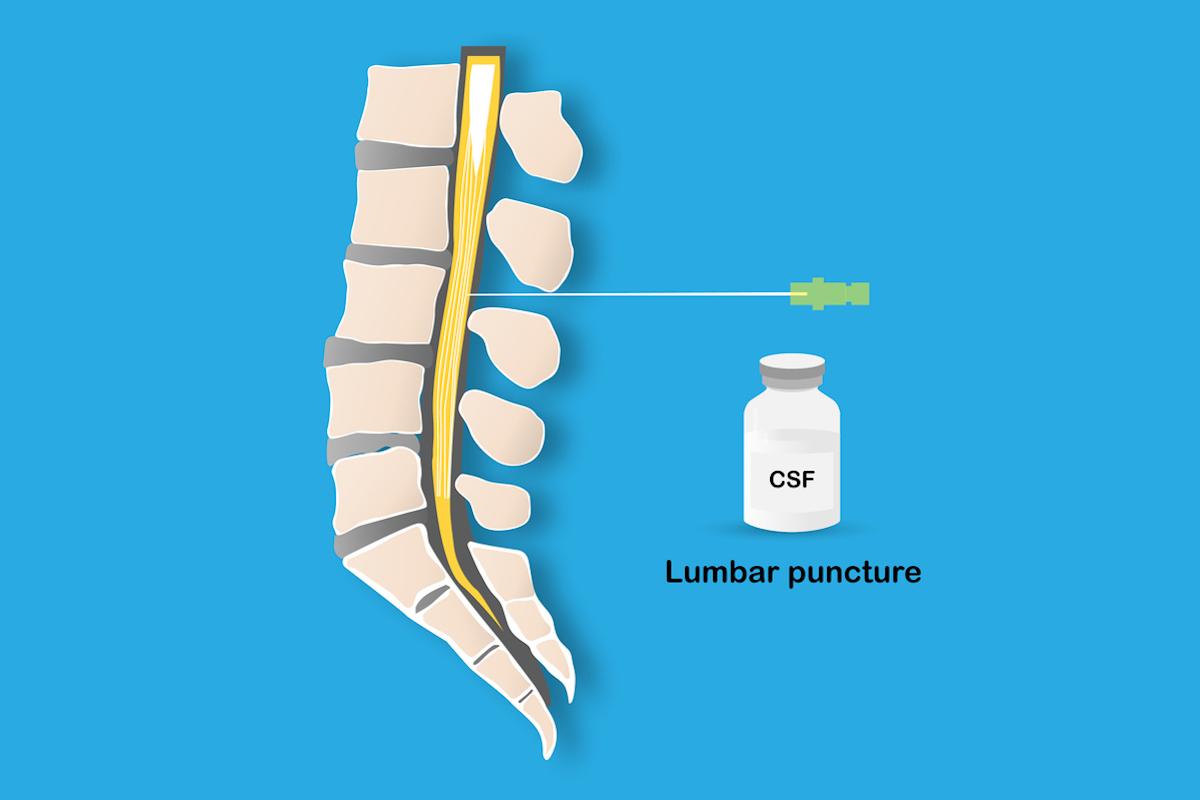
Les maladies neurodégénératives sont fréquentes mais leurs diagnostics de certitude se font à l’anatomo-pathologie. Les progrès thérapeutiques comme les anticorps anti-amyloïde créent un enjeu pour diagnostiquer ces maladies le plus précocement possible, pour que les patients puissent bénéficier d'un traitement de fond ralentissant l’évolution. Les biomarqueurs du liquide céphalo-rachidien (LCR) ont donc une importance croissante en pratique clinique, mais posent le problème de leur interprétation au regard de normes de population et de leur ajustement à des facteurs de variation non pathologique, mais une étude suédoise p (1) montre que l'intégration de protéines de référence est cruciale pour tenir compte de facteurs de confusion et améliorer les performances diagnostiques de ces biomarqueurs.
- undefined undefined/istock
Les biomarqueurs du LCR sont une technique diagnostique efficiente économiquement. Ils consistent à mesurer la concentration de protéines dans le LCR tel que le peptide amyloïde Aβ42, dont la diminution est associée à la formation de plaques amyloïdes, la protéine Tau et sa fraction phosphorylée en 181 (P-tau181), marqueur de la dégénérescence neurofibrillaire. Ces trois marqueurs correspondent à une classification dite « ATN », couramment utilisée pour classer les malades selon les désordres moléculaires liés à la maladie d'Alzheimer (2) : « A » pour les dépôts amyloïdes, « T » pour la tauopathie et « N » pour le dommage neuronale (en anglais : « Neuronal injury »). Cependant, les niveaux de ces biomarqueurs peuvent varier en situation non pathologique, ce qui complexifie leur interprétation. Leur concentration peut notamment varier selon les taux de transport des protéines du parenchyme cérébral vers le LCR par le système glymphatique ou selon les taux de production et de clairance du LCR.
Une étude suédoise parue dans Nature Communications (1) montre que l'intégration de protéines de référence est cruciale pour tenir compte de facteurs de confusion et améliorer les performances diagnostiques de ces biomarqueurs. Les auteurs proposent d'ajuster les concentrations de ces biomarqueurs par rapport aux concentrations de protéines dites de référence, afin de ne capturer que des variations pathologiques. Ceci est couramment fait avec l’Aβ40, qui est un variant non toxique de clivage du précurseur amyloïde, par rapport à Aβ42 pour considérer le ratio Aβ42/Aβ40.
Dans cette étude, les auteurs utilisent une approche bioinformatique avec un large panel de protéines pour mettre en évidence des variations interindividuelles non pathologiques du niveau de nombreuses protéines du LCR et identifier des protéines de référence qui amélioreraient les performances diagnostiques des biomarqueurs actuels de maladie d'Alzheimer.
Analyse de 2 cohortes indépendantes
Cette étude suédoise a porté sur deux cohortes indépendantes de 910 et 830 patients suivis dans deux hôpitaux universitaires. Les patients ont bénéficié d'un dosage d'un panel commercial de 2944 protéines du LCR nommé OLINK. Les patients pouvaient être normaux cognitivement, avec une plainte subjective, un trouble cognitif mineur ou une démence. Ils eurent également des PET-Amyloïdes et PET-tau à l'inclusion et furent suivi sur deux ans cliniquement pour évaluer leur conversion au stade de démence d'Alzheimer. La seconde cohorte, plus récente, avec un panel de protéines complet, servi à l'exploration et au développement des modèles, tandis que la première cohorte, au panel plus ancien et moins complet, servi de validation externe.
Les concentrations standardisées d'Aβ42 et de P-tau181 furent ajustées avec un modèle logistique multivarié pour prédire trois issues : (1) la positivité du PET-tau à partir du niveau de P-tau181, (2) la positivité du PET amyloïde à partir du niveau d’Aβ42 et (3) la conversion à deux ans au stade de démence d'Alzheimer à partir du niveau de P-tau181. Ainsi, une bonne protéine de référence devait être fortement corrélée au niveau du biomarqueur en situation non pathologique, mais pas en situation pathologique. Cette dissociation devait améliorer les performances diagnostiques du modèle ajusté.
La moitié des 2944 protéines dosées sont fortement corrélées entre elles
Sur les 2944 protéines dosées, environ la moitié apparue fortement corrélée entre elles, même en stratifiant sur l'âge et le statut cognitif. Ce groupe de protéines était notamment corrélée à la concentration moyenne standardisée de l'ensemble des protéines du panel. Cette métrique parue plus adaptée aux auteurs que la protéinorachie totale, qui aurait donné un poids excessif aux protéines d'origine sanguine, notamment l'albumine. Les auteurs montrèrent que le niveau moyen de concentration standard de protéines du LCR variait significativement en augmentant avec l'âge, le sexe masculin et diminuait avec le volume ventriculaire (mais pas le volume intracrânien), suggérant une dilution.
Les auteurs étudièrent les corrélations entre les protéines pour décrire des groupes de protéine (en anglais : « Cluster ») corrélées entre-elles. Par rapport à la moitié des protéines, ils purent réduire les candidats à un groupe de 219 protéines plus spécifiquement corrélées avec le niveau d'Aβ42 et de P-tau181 et qui améliorait les performances diagnostiques de ces biomarqueurs. Cette amélioration peut être obtenue, malgré une plus forte association de ce groupe de protéines au volume ventriculaire. Au sein de ce groupe, trois protéines candidates furent plus particulièrement analysées pour Aβ42 et P-tau181, en outre de l’Aβ40. La première étape de réduction à un groupe de protéine permis d'augmenter la robustesse des associations statistiques et leurs généralisabilités.
Pour Aβ42, la meilleure protéine de référence fut Aβ40 avec une amélioration de l'aire sous la courbe ROC pour le statut PET amyloïde de 0,97 à 0.99. P-tau181, pour lequel on n’utilise classiquement pas de protéine de référence, eu pour protéines de référence optimale la cérébellin 4 precursor (CBLN4), impliquée dans l’organisation des synapses, pour prédire le statut PET-tau (aire sous la courbe de 0.83 améliorée à 0.94). De manière notable, l’Aβ40 offrait un gain de performance proche de CBLN4 pour P-tau181. Cette découverte fut confirmée pour la prédiction de la conversion à deux ans en démence d'Alzheimer à partir du taux de P-tau181, mais ne peut pas être confirmée sur la cohorte plus ancienne, dans laquelle CBLN4 n'a pas été dosée. En revanche, Aβ40 offrait l'un des meilleurs gains de performance, amenant les auteurs à proposer le concept de protéine de référence générale, puisque sa valeur clinique dépasse l’interprétation d’Aβ42.
En se concentrant sur P-tau181, les auteurs montrent comment l'intégration d'une protéine de référence diminuait fortement le nombre de patients classés comme ayant une tauopathie sans amyloïdopathie (A-T+). Le classement révisé se rapprochait ainsi des résultats connus de PET, où ce profil est bien plus rare que prédit par les biomarqueurs. Ils allèrent jusqu'à remettre en question la notion que ce profil se démarquaient sur le plan mécanistique en réévaluant les différences statistiques de taux de biomarqueurs liés à l'activité microgliale comme le trigerring receptor expressed on myeloid cells 2 (TREM2). Les différences statistiques de concentration de ce biomarqueur entre les groupes AT(N) disparurent après l'ajustement à la neurotrophic receptor tyrosine kinase 3 (NTRK3) et la révision du classement AT obtenu avec les protéines de référence. Les relations entre plusieurs variants génétiques et les taux de biomarqueurs furent également amoindries par l'ajustement à des protéines de référence, tandis que la relation de l’allèle ε4 d’APOE, le plus important facteur de risque génétique de la maladie, avec le niveau d’expression de la protéine APOE était renforcée. Cette dernière inhibe la clairance de l’Aβ du parenchyme. L’ensemble suggère qu'il existe des biais de confusion dans plusieurs connaissances actuelles sur l'hétérogénéité de la maladie d'Alzheimer.
La variabilité inter individuelle non pathologique des biomarqueurs du LCR est établie
Cette étude établit l'existence d'une variabilité inter individuelle non pathologique des biomarqueurs du LCR. Au-delà de quelques variables démographiques et de la concentration moyenne de protéines dans le LCR, l'étude montre qu'il existe des protéines, dont le dosage individuel, permettrait de servir de référence optimale pour détecter des anomalies pathologiques. Cette approche conçoit donc l'état pathologique comme un profil dissociée en prenant le fonctionnement personnel du patient comme référence, plutôt que des seuils de concentrations dérivées de statistiques de population.
En l'occurrence, la protéine Aβ40, couramment dosée actuellement, apparaît comme une bonne protéine de référence « générale » pour à la fois Aβ42 et P-tau181. Contrairement à l'essentiel de la protéinorachie, constitué de protéines d'origine sanguine et reflétant la perméabilité de la barrière hémato-encéphalique, une protéine de référence comme Aβ40 permettrait d'interpréter les concentrations de biomarqueurs au regard du métabolisme membranaire des neurones et des dynamiques du LCR propres à chaque patient. Les auteurs proposent de la concevoir comme la "créatininurie du neurologue". Au-delà du domaine de la maladie d'Alzheimer, une telle approche de protéine de référence semble pertinente pour l'ensemble des pathologies neurologiques et psychiatriques impliquant un dosage des biomarqueurs du LCR. Les résultats de cette étude remettent également en question plusieurs relations statistiques établies entre plusieurs biomarqueurs du LCR et la maladie d’Alzheimer.
Références :
- Karlsson L, Vogel J, Arvidsson I, Åström K, Janelidze S, Blennow K, et al. Cerebrospinal fluid reference proteins increase accuracy and interpretability of biomarkers for brain diseases. Nat Commun. 1 mai 2024;15(1):3676.
- Knopman DS, Amieva H, Petersen RC, Chételat G, Holtzman DM, Hyman BT, et al. Alzheimer disease. Nat Rev Dis Primers. 13 mai 2021;7(1):1‑21.