Hématologie
CAR-T cells et risque de second cancer : mieux sélectionner les malades
Les thérapies par lymphocytes CAR-T ont tellement révolutionné le traitement des hémopathies que l’on se pose maintenant la question du risque de second cancer à long terme, un risque qui n’est pas que théorique mais qui ne semble pour l’instant pas supérieur à celui que l’on pourrait attendre chez ce type de malade.
- Alexander Kiblitskiy/istock
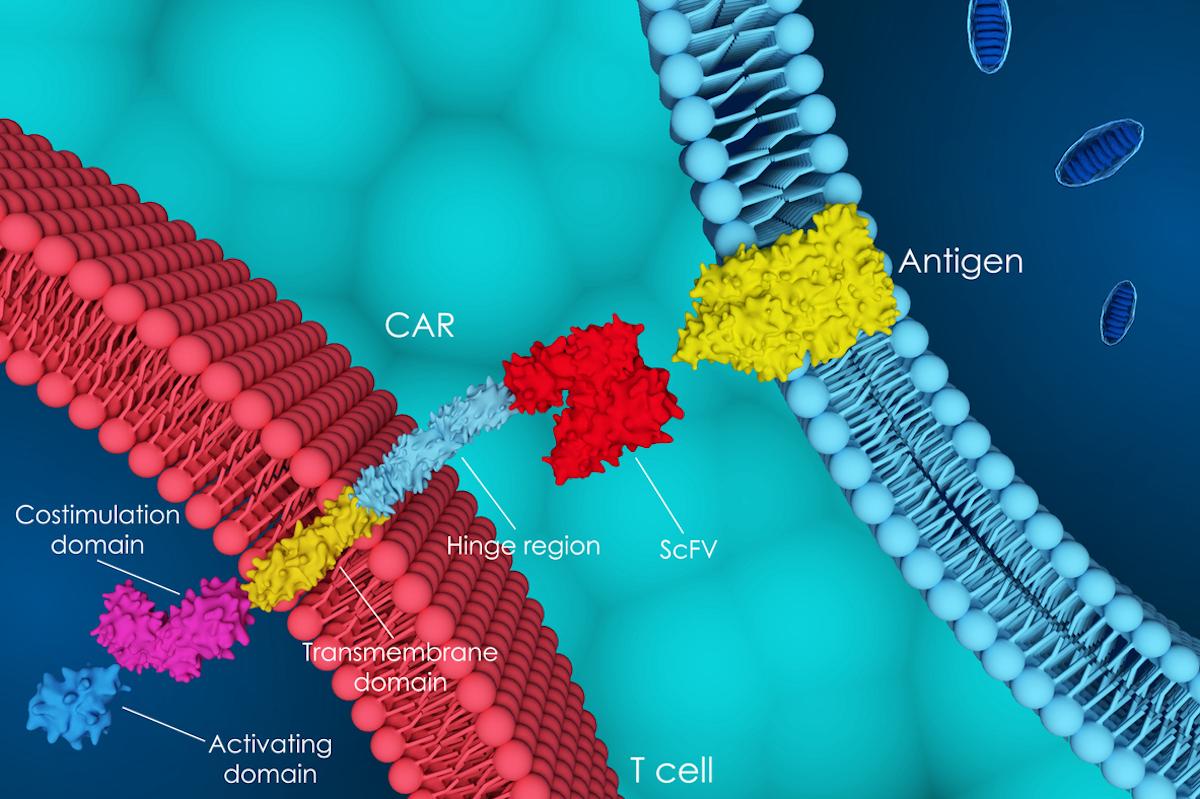
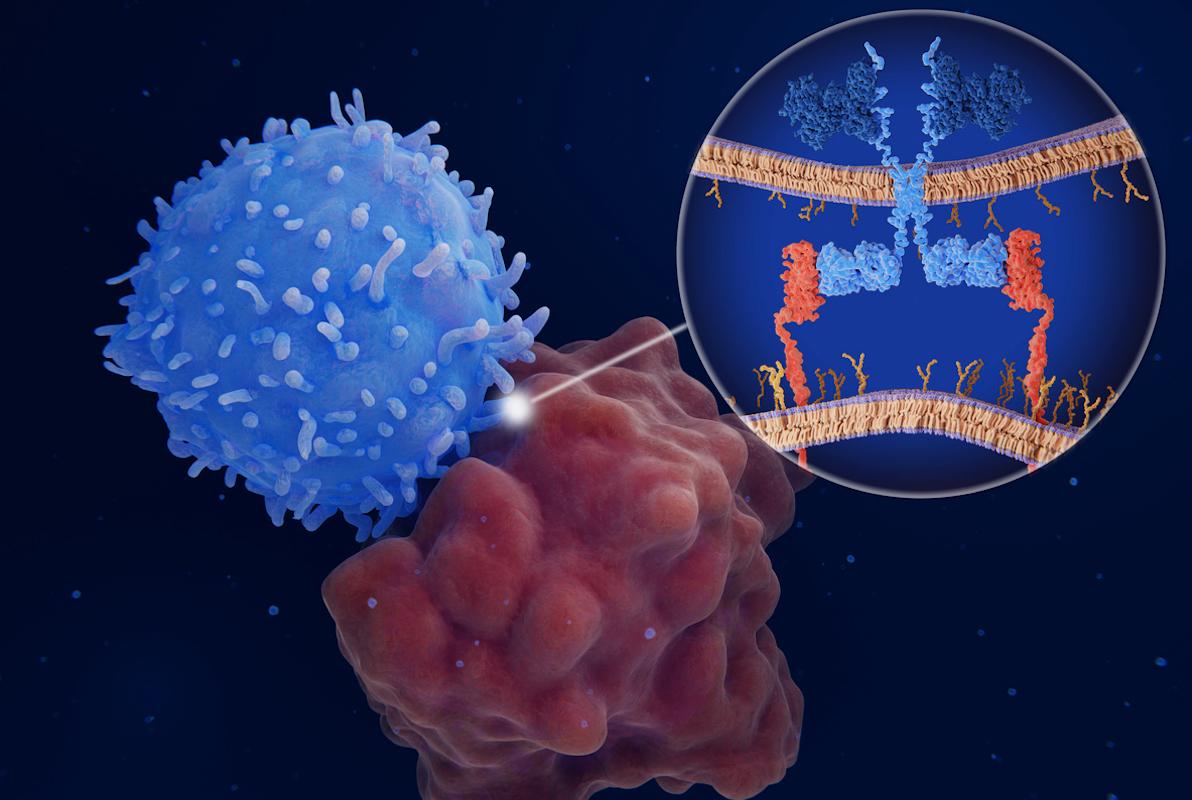
Les trois dernières décennies ont été marquées par des avancées spectaculaires dans l'utilisation des immunothérapies pour traiter le cancer, principalement sous la forme d'anticorps monoclonaux ciblant directement les cellules cancéreuses, associés ou non à une molécule cytotoxique ou même bispécifique. Plus récemment, les cellules immunitaires elles-mêmes sont utilisées comme traitements anticancéreux, avec les lymphocytes T à récepteur antigénique chimérique (CAR), des lymphocytes T autologues génétiquement modifiées pour exprimer un gène CAR.
Les gènes CAR sont conçus pour coder une protéine transmembranaire dotée d'un domaine extracellulaire de reconnaissance de l'antigène et d'un domaine intracellulaire d'activation des lymphocytes T qui permettent aux lymphocytes CAR-T de reconnaître et d'attaquer les cellules cancéreuses qui expriment leur antigène cible. L'insertion du gène dans les lymphocytes T est généralement réalisée à l'aide d'un virus.
Des effets indésirables immédiats de mieux en mieux maîtrisés
Malgré son efficacité remarquable, la thérapie par lymphocytes CAR-T n'est pas sans défis. Le processus de fabrication des lymphocytes CAR-T autologues est associé à des coûts considérables, des contraintes temporelles et des obstacles techniques. Ces problèmes ont conduit à l'exploration de la thérapie par lymphocyte CAR-T allogénique et d'autres thérapies impliquant des cellules immunitaires génétiquement modifiées pour permettre la génération d'agents immédiatement disponibles et prêts à l'emploi.
De plus, les CAR-T cells s'accompagnent d'un éventail d'effets indésirables, allant du syndrome de libération cytokinique aigu, à la neurotoxicité ou les infections, à des préoccupations à plus long terme telles que le développement potentiel de seconds cancers. Bien que les données suggèrent que le risque de seconds cancers ne soit peut-être pas plus élevé que prévu, 20 à 25 cas récents rapportés sur près de 34 000 procédures ont soulevé des questions sur le profil de sécurité, notamment en ce qui concerne les lymphomes T, à l’instar de ce qui s’est passé au cours des thérapies géniques de la moelle osseuse des immunodépressions héréditaires chez les enfants.
Deux études récentes de suivi à long terme
Des études, publiées dans le New England Journal of Medicine, éclairent la relation complexe entre la thérapie par lymphocytes CAR-T et le risque de seconds cancers. Une première étude a exploré l'incidence des seconds cancers chez 724 receveurs de lymphocytes CAR-T et rapportent une incidence relativement faible de seconds cancers, en accord avec les données précédentes, mais révélant des insights sur les mécanismes potentiels sous-jacents à leur développement. Chez une femme de 59 ans avec un lymphome diffus à grandes cellules B (DLBCL) positif à l'EBV, et qui a développé un lymphocyte T létal positif au virus d'Epstein-Barr (EBV) 54 jours après une perfusion de CAR-T CD19, les 2 lymphomes partageaient des mutations DNMT3A et TET2 identiques, un résultat qui suggèrerait une dérivation indépendante à partir d'une hématopoïèse clonale préexistante. Les auteurs n'ont trouvé aucune preuve de l'intégration du vecteur CAR dans le lymphome à cellules T et concluent raisonnablement qu'il n'était pas directement lié à la thérapie CAR.
Dans une autre étude, le cas d’un lymphome T qui s’est développé chez une femme de 71 ans 5 mois après le traitement CAR-T anti-BCMA pour myélome a été rapporté, mettant en lumière le rôle des aberrations génétiques et de l'intégration du vecteur viral. Le lymphome à cellules T présentait une intégration du vecteur CAR dans le deuxième intron de SSU72, un gène jouant un rôle dans l'homéostasie des lymphocytes T. Cependant, les auteurs n'ont trouvé aucune preuve que l'insertion affectait l'expression de l'ARNm SSU72 et ont identifié d'autres aberrations génétiques qui pourraient être à l'origine du néoplasme. Il n'a pas été possible de déterminer si un clone précurseur était présent avant la transduction.
Ces résultats soulignent la nécessité d'une évaluation complète des risques et d'une vigilance persistance dans le suivi des patients recevant une thérapie par lymphocytes CAR-T.
Mieux comprendre pour améliorer la stratification des risques
D’après un éditorial associé, il est rappelé que l'hématopoïèse clonale sporadique augmente le risque de cancer myéloïde et, dans une moindre mesure, de cancer lymphoïde. L'hématopoïèse clonale est fréquente chez les personnes recevant une thérapie CAR et était détectable chez 74 des 154 patients d'une étude. Par conséquent, des milliers de receveurs de thérapie CAR ont dû héberger des clones préexistants, ce qui rassure considérablement sur le fait que l'hématopoïèse clonale n'est pas forcément associée à un risque substantiellement accru de cancer des lymphocytes T ou d'un autre cancer hématologique secondaire.
Néanmoins, malgré l'absence d'une voie étiologique claire, la possibilité que des lymphocytes CAR-T pourraient occasionnellement évoluer vers un lymphome à cellules T, dont le risque peut être plus élevé lorsque des clones de cellules T prémalignes sont présents avant le prélèvemen,t ou la possibilité qu’un cancer lymphoïde EBV-positif soit plus susceptible de survenir à partir de clones d'hématopoïèse prémalins ou clonaux après une thérapie par lymphocytes CAR-T, suggère qu’il est nécessaire d’élucider les mécanismes sous-jacents au développement de seconds cancers afin d’affiner les stratégies de stratification des risques et améliorer les critères de sélection des patients.