Gastro-entérologie
Maladies inflammatoires chroniques de l'intestin : cibler le bon récepteur TNF
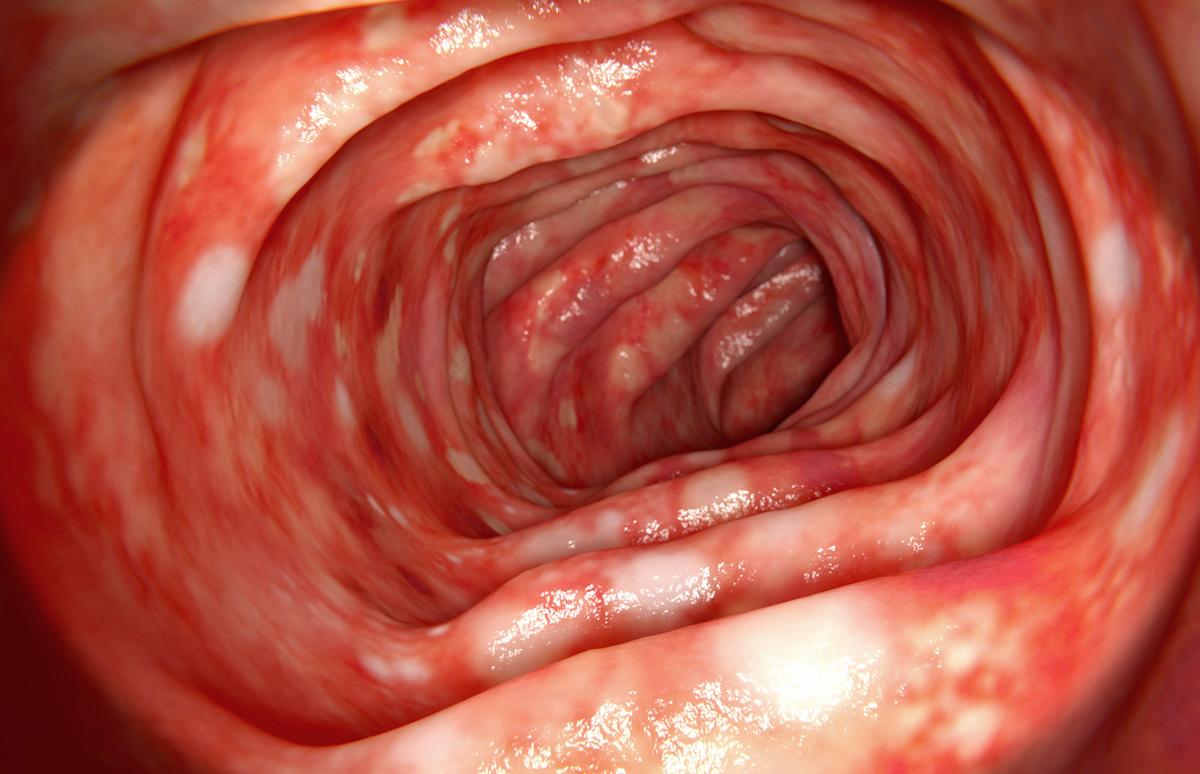
Il existe 2 récepteurs TNF-alpha différents, TNFR1 et TNFR2, sur chaque cellule. Actuellement, en cas d’inflammation chronique, les anti-TNF bloquent les 2 récepteurs, ce qui empêcherait les possibilités de réparation liées au TNFR2 dans les MICI.

- MARHARYTA MARKO/istock
En cas d’inflammation, le TNF-alpha joue un rôle à la fois dans la destruction et la réparation des tissus et il existe 2 récepteurs TNF-alpha différents, le TNFR1 et le TNFR2, dans chaque cellule du corps humain. Actuellement, les anti-TNF bloquent à la fois le TNFR1 et le TNFR2. Or, selon les tissus, et en particulier dans l’intestin, le TNFR2 pourrait avoir un rôle réparateur.
En cas de blocage des deux récepteurs dans les MICI avec un anti-TNF, on empêcherait à la fois les effets destructeurs et réparateurs liés au TNF-alpha. Pour contourner ce problème, des chercheurs de l'université de Californie conseillent un ciblage sélectif du TNFR1 dans les colites inflammatoires. Leur étude, in vivo chez la souris, est publiée dans le Journal of Crohn’s and Colitis.
MICI : rôle incomplet des anti-TNF
La maladie de Crohn et la rectocolite hémorragique sont généralement traitées avec l'une des nombreuses biothérapies anti-TNF alpha disponibles, biothérapies qui empêchent la molécule inflammatoire « facteur de nécrose tumorale alpha », ou TNF-alpha, de se lier à deux récepteurs, TNFR1 et TNFR2. Mais, au final, seulement 50% des malades seraient soulagés sur le long terme par un anti-TNF.
Le TNF-alpha est une cytokine à l'origine d'une grande partie de l'inflammation et de la destruction des tissus dans les MICI, mais il existe deux récepteurs différents, TNFR1 et TNFR2, sur chaque cellule qui se lient au TNF-alpha. Actuellement, les anti-TNF bloquent à la fois le TNFR1 et le TNFR2.
MICI : rôle protecteur du TNFR2
Or, dans les MICI, le TNF-alpha, produit par les cellules de l'organisme, induit des cellules immunitaires spécialisées et d'autres cellules, qui favorisent ou suppriment l'inflammation. Ainsi, le TNF-alpha joue un rôle à la fois dans la destruction et la réparation des tissus : ce serait une arme à double tranchant.
Il existe ainsi des preuves que le TNFR1 pourrait être à l'origine de la plupart des effets destructeurs dans les MICI, tandis que le TNFR2 pourrait être à l'origine des effets curatifs et réparateurs.
Argument en faveur des rôles différents de TNFR1 et TNFR2
Le groupe de chercheurs californiens a été orienté par différents éléments de preuve suggérant que le ciblage spécifique du TNFR1 pourrait être une stratégie plus intéressante dans les MICI. Les chercheurs ont utilisé un inhibiteur sélectif pour bloquer le TNFR1 dans un modèle de souris avec MICI. Ils ont constaté que les souris traitées avec cet inhibiteur en tiraient des bénéfices très net. Ils ont également effectué un ciblage génétique du TNFR1 afin de réduire sa signalisation. L'impact a été spectaculaire.
D’autre part, les souris qui ont une déficience génétique en TNFR2 présenteraient une maladie inflammatoire beaucoup plus grave, ce qui suggère que le TNFR2 aurait effectivement des effets bénéfiques. Cette approche spécifique pourrait donc offrir plus de possibilités au TNFR2 de contribuer à la guérison des MICI.
Une différence selon les tissus
Le TNF-alpha est un effecteur commun très fréquent par lequel l'organisme réagit à des déclencheurs inflammatoires, comme par exemple une infection. Cette protéine sert ainsi de médiateur à plusieurs processus pathologiques de l'organisme favorisant l'inflammation. L'inflammation survient pour éliminer une infection ou tuer une cellule tumorale mais dans les maladies auto-immunes, l'inflammation se chronicise et les lésions tissulaires provoquées par le TNF-alpha sont responsables de la maladie.
L’objectif, au final, est que le TNF-alpha arrive au bon moment pour éliminer une certaine cause d’inflammation, mais une fois que cette tâche accomplie, l’objectif est que cette protéine n’agisse plus sur les récepteurs associés à la destruction tissulaire mais sur ceux activant la réparation tissulaire. De nombreuses maladies, comme la polyarthrite rhumatoïde, la sclérose en plaques et le psoriasis, sont liées à la persistance du TNF-alpha dans les tissus et à l’absence de réparation. Mais, les différents tissus de l'organisme seraient différemment sensibles aux effets du TNF-alpha. Le rôle des récepteurs TNFR1 et TNFR2 pourrait donc varier selon les différents tissus.