Infectiologie
Covid-19 : bons résultats du traitement antiviral de Pfizer, y compris sur Omicron
Administré dans les premiers jours d’une infection à Covid 19, le nirmatrelvir associé au ritonavir réduirait de près de 90% le risque d'hospitalisation et de décès chez les malades à risque et de 70% chez les malades tout venants. In vitro, le nirmatrelvir serait efficace sur le variant Omicron.
- Plyushkin/istock
Pfizer a déclaré que si le Paxlovid® (nirmatrelvir) est administré, dans les trois jours suivant l'apparition des symptômes d’une infection Covid-19 (et en association au ritonavir), il réduirait le risque d'hospitalisation et de décès de 89% à J28. S'il est administré dans les cinq jours, le risque serait réduit de 88% à J28.
Ces résultats sont basés sur l'analyse des 2 246 participants inclus dans l’étude EPIC-HR (Evaluation of Protease Inhibition for Covid-19 in High-Risk Patients). Chez des malades non vaccinés et à risque élevé de forme grave de la maladie, ces résultats définitifs correspondent en grande partie à l'analyse intermédiaire, présentée le mois dernier, sur une population plus restreinte (n=774).
Surtout, la réduction du risque relatif chez les patients âgés de 65 ans ou plus serait de 94%, l'une des populations les plus exposées au risque d'hospitalisation ou de décès ; 1,1% des patients ayant reçu Paxlovid® ont été hospitalisés jusqu'au 28e jour (1/94 hospitalisés sans décès), contre 16,3% des patients ayant reçu le placebo (16/98 hospitalisés avec 6 décès), avec une signification statistique élevée (p<0,0001).
Réduction de près de 90% des risques
L'étude EPIC-HR (Evaluation of Protease Inhibition for Covid-19 in High-Risk Patients), de phase 2/3, a débuté en juillet 2021. Les malades recrutés avaient un diagnostic (confirmé en laboratoire) d'infection par le SARS-CoV-2 avec des symptômes légers à modérés depuis moins de cinq jours et devaient avoir au moins un facteur de risque ou une comorbidité associée à un risque accru de développer une forme grave de la Covid-19. Chaque malade a été randomisé pour recevoir, soit le nirmatrelvir (ou PF-07321332) + ritonavir, soit un placebo + ritonavir, par voie orale toutes les 12 heures pendant cinq jours.
Selon cette nouvelle analyse sur l’ensemble des malades inclus, 0,7% des patients ayant reçu Paxlovid® ont été hospitalisés dans les 28 jours suivant leur entrée dans l'essai, et aucun n'est décédé. En revanche, 6,5% des patients ayant reçu un placebo ont été hospitalisés ou sont décédés.
Chez les patients à faible risque aussi
Pfizer a également publié les données préliminaires d'un essai distinct portant sur des personnes ayant un risque moindre de forme grave de la Covid-19, l’essai EPIC-SR (Evaluation of Protease Inhibition for Covid-19 in Standard-Risk Patients). Ces volontaires comprenaient des personnes vaccinées qui avaient au moins un facteur de risque de maladie grave, ainsi que des patients non vaccinés n’ayant aucun facteur de risque. Parmi ce groupe de 662 volontaires, Paxlovid® a réduirait de 70% le risque d'hospitalisation et de décès, a déclaré la société.
Dans cette analyse, 0,7% des patients ayant reçu Paxlovid® ont été hospitalisés après la randomisation (3/428 hospitalisés sans décès), comparativement à 2,4% des patients ayant reçu le placebo et qui ont été hospitalisés ou sont décédés (10/426 hospitalisés sans décès) ; p=0,051.
Efficacité in vitro sur le variant Omicron
Dans les deux essais, la plupart des volontaires étaient infectés par le variant Delta. Mais Pfizer a déclaré mardi que, lors d'expériences in vitro, le Paxlovid® a également donné de bons résultats de blocage de la réplication du variant Omicron, malgré son grand nombre de mutations.
D’après Pfizer, le médicament bloque l'une des protéase clés du variant Omicron tout aussi efficacement qu'il le fait sur les autres variants.
Un nouvel antiviral spécifique en association
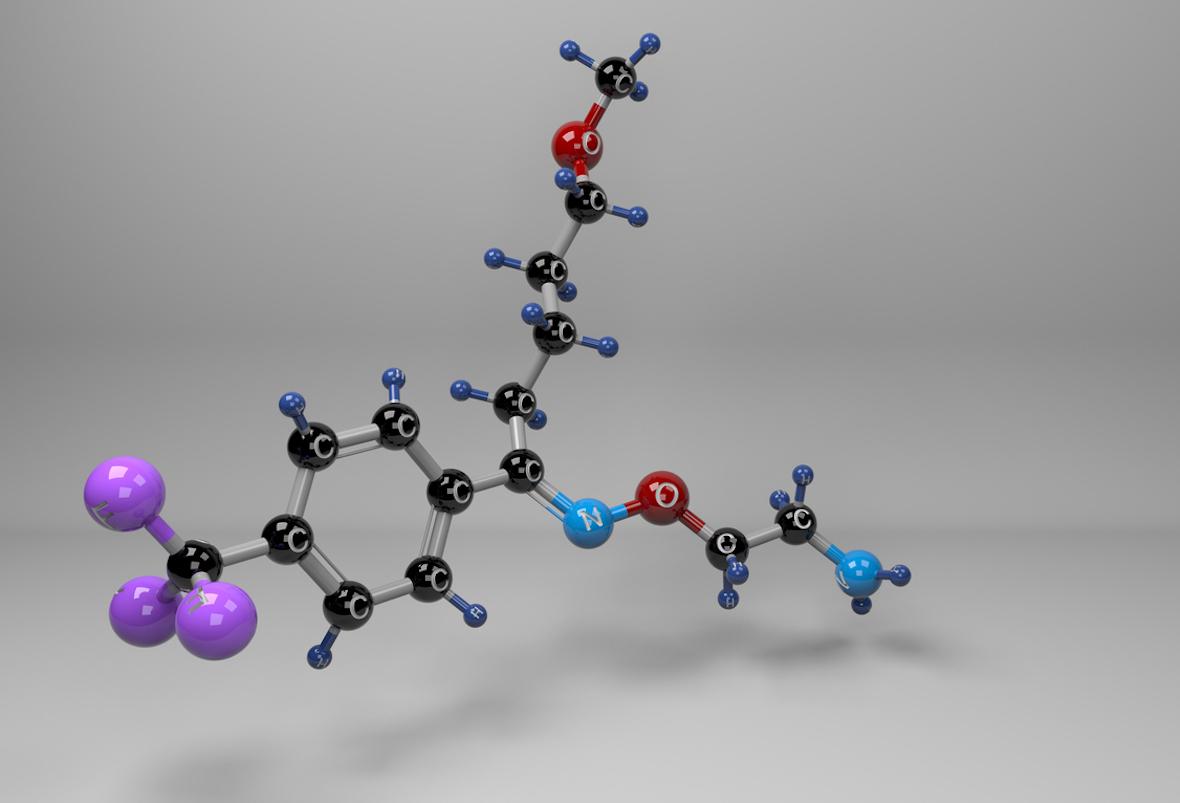
Le nirmatrelvir est un traitement antiviral expérimental de type inhibiteur de protéase du SARS-CoV-2, spécifiquement conçu pour être administré par voie orale (en association au ritonavir) afin qu'il puisse être prescrit dès les premiers signes d'infection ou même dès la révélation d'une exposition au SARS-CoV-2 (prophylaxie).
Cette molécule était jusqu’à maintenant connue sous le code PF-07321332 et elle bloque l'activité de la protéase du SARS-CoV-2-3CL, une enzyme dont le coronavirus a besoin pour se répliquer. L'administration concomitante d'une faible dose d’une autre anti-protéase, le ritonavir, déjà disponible car utilisé dans le traitement des infections à VIH, permettrait de ralentir le métabolisme ou la dégradation du PF-07321332 afin qu'il reste actif dans l'organisme pendant plus longtemps et à des concentrations plus élevées pour combattre le virus.
Une demande d’AMM renforcée
Le mois dernier, Pfizer a demandé à la Food and Drug Administration d'autoriser son association antivirale sur la base d'une analyse préliminaire. Les nouveaux résultats vont sans aucun doute renforcer la demande d’AMM, d’autant que le monulpiravir de Merck, annoncé initialement capable de donner une réduction de 50% du risque, peine à convaincre les autorités de santé avec ses 30% de réduction de l’analyse finale.
Pfizer pourrait mettre à disposition 180 000 traitements immédiatement si le Paxlovid® était autorisé maintenant. Dans le même communiqué, la société prévoit de rendre 80 millions de traitements disponibles dans le monde en 2022.