Comité d'experts
Essai clinique de Rennes : des règles de "bon sens" n’ont pas été respectées
Le comité d’experts a émis son rapport final sur l’essai clinique de Rennes, qui s’est soldé par la mort d’un participant. Il pointe de graves erreurs.

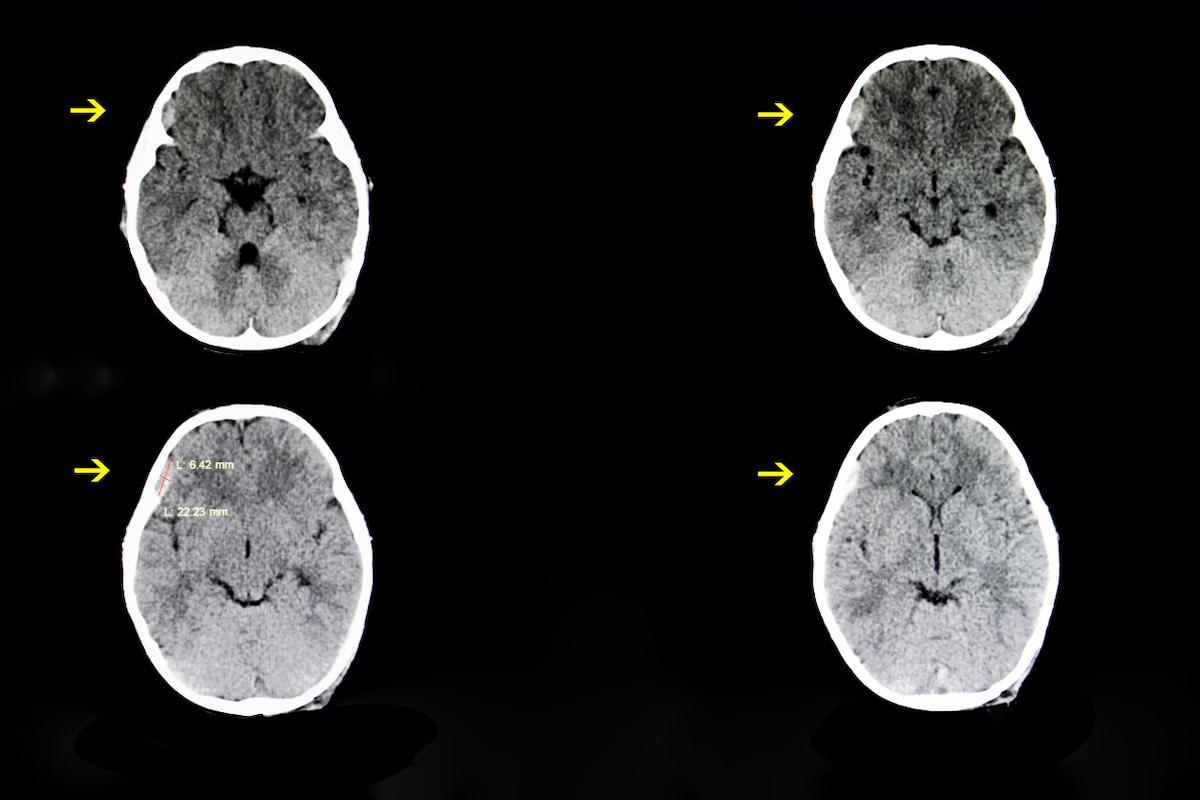
C’est bien la molécule qui est en cause dans l’accident survenu en janvier dernier à Rennes, lors de l’essai clinique qui a mené au décès d’un volontaire sain, et à l’hospitalisation de cinq autres personnes. Telle est la conclusion du groupe d’experts mis en place par l’ANSM au lendemain de cet événement. Le rapport final a été publié ce mardi.
L’accident est ainsi « clairement lié » à la toxicité de la molécule BIA 10-2474, mise au point par le laboratoire portugais Bial et testée dans les locaux de Biotrial, en Bretagne. Ces résultats confirment les pistes évoquées précédemment par les experts.
Essai mené "tambour battant"
Par ailleurs, « il est très peu probable que cette toxicité soit liée à la stimulation du système endocannabinoïde via l’inhibition de la FAAH (cible pharmacologique du BIA 10?2474). » La molécule aurait eu un effet plus large que celui escompté, et aurait touché d’autres neurotransmetteurs, provoquant des dégâts « collatéraux » (lésions cérébrales, décès).
Globalement, « les règles semblent avoir été respectées », ce qui explique que le protocole ait été validé sur le plan formel. D’ailleurs, « les données transmises, notamment la Brochure Investigateur, ne contenaient pas d’informations (y compris toxicologiques) de nature à faire craindre un risque particulier lors d’une première administration à l’homme », soulignent les experts.
Mais en pratique, certaines règles élémentaires, relevant du « bon sens », ont été omises. Le comité s’interroge ainsi sur le schéma d’administration des doses répétées (multiple ascending dose, MAD), qui échappe à toute logique.
« L’accélération peu compréhensible de l’escalade des doses entre les cohortes MAD 20 et 50 mg a vraisemblablement joué un rôle important dans le déclenchement de l’accident », notent les experts, qui dénoncent le rythme de l’essai, mené « tambour battant » dans ses phases avancées. Chose surprenante, alors que « le début de l'essai a été très prudent », soulèvent-ils encore.
Un médicament peu efficace
En outre, la brochure investigateurs comportait « un assez grand nombre d’erreurs, d’imprécisions, d’inversion de chiffres ou de traduction erronée des documents sources qui rendent la compréhension difficile sur plusieurs points. Ceci est tout à fait surprenant du fait de l’importance réglementaire de ce document », peut-on encore lire.
Les experts émettent des recommandations pour améliorer la sécurité des volontaires sains qui participent à ce type d'essai. Dans le cas présent, il s’agirait d’ « une molécule moins efficace qu'un médicament » déjà commercialisé et « pas plus efficace que plusieurs molécules de la même famille qui avaient été abandonnées pour cause d'inefficacité », a expliqué à l’AFP le Pr Bernard Bégaud, qui a présidé le comité d’experts.
« D'où la première recommandation du rapport qui est au minimum de s'assurer qu'un médicament a une chance de servir à quelque chose, explique-t-il. Justifier l'intérêt d'une molécule devrait être un préalable avant d'autoriser un essai ».