Polyarthrite rhumatoïde : traiter tôt pour protéger ses articulations

La polyarthrite rhumatoïde est une maladie articulaire auto-immune, cause la plus fréquente des douleurs inflammatoires des articulations des mains et des pieds, c'est-à-dire prédominant le matin. Les progrès du diagnostic, de la surveillance et du traitement ont complètement transformé le pronostic de ce rhumatisme inflammatoire chronique.
Par le Dr Jean-Paul Marre, rhumatologue, CHU Pitié-Salpêtrière, Paris
Des mots pour les maux
La polyarthrite rhumatoïde est un rhumatisme inflammatoire chronique
Le gonflement des articulations est en rapport avec une maladie de la membrane synoviale qui tapisse l'intérieur de l'articulation.
L’inflammation de la synoviale est responsable d’une synovite agressive qui peut aboutir à une destruction du cartilage et de l’articulation
Il s’agit d’une maladie auto-immune, c’est-à-dire liée à un dérèglement de l’immunité
Le traitement est basé sur les immunosupresseurs, les corticoïdes et les biothérapies
Quels sont les signes d’alerte ?
Des douleurs des articulations des mains ou des pieds, symétriques, qui apparaissant à la fin de la nuit, voire provoquent un réveil très matinal, doivent attirer l’attention. Elles s’accompagnent d’une raideur des articulations au réveil, qui diminue avec la reprise de l’activité : c’est le "dérouillage matinal", signe caractéristique de la douleur au cours des rhumatismes inflammatoires, dont la polyarthrite rhumatoïde. Un gonflement persistant des articulations douloureuses, témoignant de l'hypertrophie de la membrane synoviale, apparaît parfois.
Qu’est-ce que la PR ?
La polyarthrite rhumatoïde est une maladie inflammatoire chronique qui touche plusieurs articulations. Elle est caractérisée par une inflammation importante de la membrane synoviale qui tapisse l’intérieur de la capsule qui entoure les articulations. Ces dernières deviennent alors gonflées et douloureuses.
La membrane synoviale inflammatoire peut sécréter un liquide qui s’accumule dans l’articulation : c’est l’épanchement de synovie ou épanchement articulaire. Ces phénomènes peuvent aboutir à une déformation et à une destruction de l’articulation par l’atteinte du cartilage et de l'os sous le cartilage.
Comment explique-t-on cette réaction inflammatoire anormale dans les articulations ? Normalement chargé de s’attaquer aux agents agresseurs du corps humain tels que les virus et les bactéries, le système immunitaire se retourne contre les propres cellules de l’organisme que sont les constituants de l’articulation, et les détruit pour une raison encore inconnue. C’est pourquoi on parle de maladie auto-immune.
Comment se manifeste-t-elle ?
Le signe principal de la maladie est la douleur due à l’inflammation. Elle est assez caractéristique et survient généralement à la fin de la nuit, devient maximale au réveil et s’accompagne d’une raideur des articulations qui s’atténue avec la reprise de l’activité : c’est ce que l’on appelle le « dérouillage matinal ».
La maladie touche la plupart des articulations, plus fréquemment les mains et les pieds de façon symétrique, à l’exception de la colonne vertébrale qui est rarement atteinte. Au niveau des mains, l’inflammation a une répartition particulière : elle épargne les articulations du bout des doigts (IPD), mais touche les deux autres articulations des doigts (métacarpophalangiennes et interphalangiennes proximales). Dans la PR, l’inflammation n’est pas seulement locale, elle est aussi générale, touchant tout l'organisme, et peut être responsable d’une fatigue et d'une athérosclérose accélérée.
Si la maladie n’est pas prise en charge et traitée assez rapidement et énergiquement, les articulations touchées se détruisent progressivement et dans certains cas handicapent lourdement le malade. Ceci ne doit plus arrver avec les prises en charge modernes.
Quelles sont ses causes ?
Les causes de la polyarthrite rhumatoïde, comme celles de toutes les maladies auto-immunes, sont encore mal connues. Pourquoi le système immunitaire de l’organisme se dérègle-t-il et s’attaque-t-il aux cellules de la membrane synoviale de ses propres articulations, provoquant une forte réaction inflammatoire ? Plusieurs hypothèses sont actuellement avancées mettant en cause des agents tels que des bactéries, des virus, le tabac ou encore un trouble hormonal ou psycho-affectif. Par ailleurs, bien que la polyarthrite rhumatoïde ne soit pas une maladie héréditaire, il est possible qu’il en existe plusieurs cas au sein d’une même famille ; on parle alors de prédisposition génétique. Il semble donc qu’il n’existe pas une seule et unique cause à la maladie mais que plusieurs facteurs présents chez une même personne participent à son déclenchement.
De nombreuses personnes attribuent le déclenchement de cette maladie à la survenue d’un événement de la vie vécu douloureusement comme un deuil, un divorce ou un accident. Les travaux menés dans cette direction n’ont rien démontré de manière certaine et c’est la notion de coïncidence qui a été retenue.
Qui est atteint de PR ?
La polyarthrite rhumatoïde est une maladie fréquente qui touche environ 0,5 % de la population générale en France, soit près de 350 000 personnes, mais dont la gravité est modérée dans la majorité des cas.
Elle atteint surtout les femmes, le plus souvent entre 40 et 60 ans, mais elle peut aussi concerner les enfants, les hommes et les femmes jeunes.
La fréquence est d’autant plus élevée chez la femme que la maladie débute plus précocement (3,7 femmes pour 1 homme si la PR débute avant 30 ans), la fréquence est identique chez l'homme et la femme si la polyarthrite débute après 60 ans.
Si la cause exacte de la maladie reste encore inconnue, certains facteurs de risque de la PR ont été identifiés. Les fumeurs par exemple ont un risque plus élevé d’en être atteint et la maladie est de plus mauvais pronostic si le tabagisme persiste. En revanche, les femmes prenant une contraception hormonale ou ayant eu de nombreuses grossesses sont à moindre risque. Il existe un terrain génétique prédisposant en rapport avec le système HLA mais l’existence de ce terrain n'implique aucunement la survenue de la maladie. Enfin, on sait depuis peu que les personnes en bonne santé, mais qui ont dans leur sang du facteur rhumatoïde ou des anticorps anti-peptides citrullinés (cf. question 7), sont à plus grand risque de développer la maladie. Des études sont en cours pour essayer de prévenir le passage à la PR avérée.
Comment évolue la PR ?
L'évolution naturelle de la maladie se fait soit vers la guérison ou la rémission sans traitement (éventualité rare), soit vers une stabilisation de l’inflammation grâce à un traitement léger (rémission sous traitement) avec possibilité de décroissance secondaire de l'intensité du traitement (cas le plus fréquent désormais), soit vers une extension de l'atteinte articulaire, avec apparition de lésions plus ou moins sévères du cartilage, de l'os et des tendons.
L'évolution habituelle se fait le plus souvent par poussées, plus ou moins longues et d'intensité variable, entrecoupées de rémissions (disparition des manifestations cliniques), imprévisibles et parfois définitives. Ces périodes de rémissions sont d’autant plus fréquentes qu’un traitement efficace a été mis en route de façon précoce.
Quelle est la différence entre rémission et guérison ?
Il y a guérison quand la maladie disparaît avec le traitement et ne revient pas plusieurs années après l'arrêt de ce traitement. Il y a rémission quand la maladie disparaît avec le traitement, mais revient à l'arrêt du traitement, ce qui impose son maintien aussi longtemps que nécessaire, en recherchant la dose minimale efficace.
A l'heure actuelle, les résultats de certaines études laissent espérer qu'un traitement efficace et intense, administré de manière très précoce (dès le début de la maladie, voire avant), pourrait augmenter les chances de guérison. Ce même traitement permet en tout cas de diminuer le risque de lésions articulaires, de mise en place de prothèses articulaires et de handicap.
Peut-on prévoir l’évolution de la maladie ?
Sans que l'on puisse être certain du destin de chaque individu, il existe maintenant des scores (établis à partir des signes cliniques, biologiques et radiologiques) qui permettent d'estimer le risque d'avoir une maladie sévère dans le futur et donc de décider la prescription de traitements efficaces et spécifiques. Dans ce contexte, il est important de souligner le caractère néfaste du tabagisme (+++), d’un trop long délai de mise en route d’un traitement efficace, d’un mauvais suivi de ce traitement et d’intervalles entre les consultations trop importants, tous ces éléments conduisant à un retard dans l'ajustement du traitement et l’obtention d’un bon contrôle de la maladie.
Ceci doit inciter les personnes souffrant d’un gonflement de leurs articulations à consulter rapidement un médecin dès les premiers signes (moins de 6 semaines en théorie). Il faut qu’ils acceptent d’affronter d'emblée la maladie et de prendre un traitement, en n’hésitant pas à consulter à nouveau si les médicaments ne donnent pas satisfaction dans un délai qui ne doit pas dépasser 3 mois. Le succès du traitement en dépend.
Quelles sont les complications qui peuvent survenir ?
Les déformations articulaires, les douleurs et l’impotence en rapport avec une destruction du cartilage et de l'os sont les complications les plus fréquentes de la maladie et peuvent être évitées par les traitements disponibles.
On peut aussi considérer comme complication les manifestations extra-articulaires, non pas tant les nodules sous-cutanés, qui sont rarement invalidants, que les exceptionnelles, mais sévères, atteintes tardives témoignant d’une extension de la maladie auto-immune aux petits vaisseaux sanguins. Cette vascularite peut être responsable d’atteintes oculaires, pulmonaires, cardiaques, voire neurologiques.
Enfin, il est nécessaire d’insister sur 3 types de complications : les infections, l’athérosclérose et le cancer.
La polyarthrite rhumatoïde étant liée à un désordre du système immunitaire dans son ensemble, celui-ci est également moins efficace pour protéger les malades contre les infections. Celles-ci sont donc plus fréquentes, en particulier en ce qui concerne les voies respiratoires. Ce problème est d’autant plus important que le risque d’infection est également augmenté par le traitement, qu’il soit corticoïde ou immunosuppresseur. Il est donc important de vacciner les malades souffrant de polyarthrite rhumatoïde contre le pneumocoque et la grippe.
Ce désordre immunitaire et inflammatoire est également incriminé comme étant à l’origine de l’augmentation du risque de certains types de cancers du sang : les lymphomes. Ces cancers sont clairement plus fréquents au cours de la polyarthrite rhumatoïde que dans la population normale, et il n’est pas exclu que certains traitements puissent augmenter faiblement cette fréquence. C’est pour cela que des registres de suivi des malades sur le long terme sont actuellement menés.
Enfin, l’athérosclérose, qui se rencontre très fréquemment dans nos sociétés d’abondance et de sédentarité, est plus fréquente au cours de la polyarthrite rhumatoïde et elle est plus rapidement évolutive, avec un risque augmenté d'accidents coronariens. Ceci impose une prise en charge vigoureuse, tant de la polyarthrite rhumatoïde, que de l’athérosclérose et des facteurs de risque cardiovasculaires traditionnels.
Pourquoi la PR est-elle une maladie à risque cardiovasculaire ?
La polyarthrite rhumatoïde, comme le diabète, est une maladie à risque cardiovasculaire élevé. L’augmentation de ce risque apparaît liée à l’activité même de la maladie immunitaire, peut-être à l’inflammation elle-même, et à une augmentation des facteurs de risque traditionnels (hypertension artérielle, cholestérolémie, tabac…). L’influence des traitements sur ce risque cardiovasculaire n’est sans doute pas anodine.
L’impact de la plupart des anti-inflammatoires non-stéroïdiens (AINS) sur le risque cardiovasculaire est mal connu, mais il n’est certainement pas nul : il est donc nécessaire de surveiller la pression artérielle au cours de leur prescription. Les corticoïdes doivent également être prescrits à la dose la plus faible possible.
Il faut obtenir un bon contrôle de la maladie pour réduire le risque de maladie cardiovasculaire. La meilleure preuve en est que les traitements de fond les plus puissants (anti-TNF et méthotrexate), réduisent le risque cardiovasculaire au cours de la polyarthrite rhumatoïde.
Il faut évaluer annuellement le risque cardiovasculaire global au cours d’une polyarthrite rhumatoïde selon les recommandations internationales : l’évaluation du risque peut être réalisée avec le score européen SCORE. Il faut multiplier par 1,5 le score de risque obtenu sur les systèmes de calcul en vigueur si la polyarthrite rhumatoïde s’accompagne d’au moins 2 des facteurs suivants :
• Durée d’évolution supérieure à 10 ans
• Présence de facteur rhumatoïde et/ou d’anticorps anti-CCP
• Existence de signes extra-articulaires
En présence de facteurs de risque (cholestérol et/ou pression artérielle), des statines, des inhibiteurs de l’enzyme de conversion de l’angiotensine et/ou des inhibiteurs des récepteurs de l’angiotensine II sont généralement prescrits.
Comment fait-on le diagnostic ?
Il est souvent difficile à établir avec certitude au début de la maladie. Le médecin étudie d’abord les signes cliniques. Des douleurs articulaires des petites articulations des mains réveillant le malade le matin et s’accompagnant d’une raideur matinale sont assez évocatrices si elles sont symétriques et s’accompagnent d’un gonflement persistant. Mais les symptômes ne sont généralement pas suffisants pour le diagnostic et il faut recourir aux examens biologiques et radiologiques.
Dans le sang, on recherche des signes d'inflammation : augmentation de la vitesse de sédimentation (VS) et de la Protéine C Réactive (CRP), ainsi qu'une anémie (hémoglobine, Hg, basse). Le facteur rhumatoïde n’est pas toujours présent au début de la maladie (le test au Latex ou la réaction au Waaler Rose ne sont quasiment plus utilisés). Les anticorps anti-CCP (anticorps anti-peptides citrullinés ou anti-kératine) sont également recherchés car, outre leur utilité diagnostique, ils ont également un rôle pronostique. Le dosage d’autres anticorps comme les anticorps anti-nucléaires est également réalisé à ce stade pour éliminer d’autres maladies auto-immunes.
Les radiographies sont souvent normales au début de la maladie, les signes radiologiques n’apparaissant que plusieurs mois après les premiers symptômes. On observe alors une déminéralisation des articulations touchées, un pincement d’un ou plusieurs interlignes articulaires et de petites érosions osseuses. L'IRM (Imagerie par Résonance Magnétique nucléaire) et l'échographie articulaire sont des examens qui permettent de visualiser de façon plus précoce et plus précise la lésion fondamentale de la polyarthrite rhumatoïde : l’inflammation de la membrane synoviale ou synovite. Ces examens permettent également de détecter précocement des lésions articulaires. Ils peuvent également révéler le caractère symétrique des atteintes articulaires, très évocateur de la polyarthrite rhumatoïde.
A quoi sert l’écho-doppler articulaire ?
L’échographie est une méthode d’imagerie basée sur l’analyse de la réflexion des ultrasons qui permet de bien étudier les tissus mous. Grâce à cette technique, il est possible avec un tout petit appareil d’analyser l’aspect de la membrane synoviale d’une articulation et de détecter un épanchement de liquide intra-articulaire, même de très petite taille. La membrane synoviale est la structure articulaire qui est atteinte en premier par l’inflammation au cours de la PR : son épaississement correspond à une synovite. La synovite est modeste au début de la maladie, mais en l’absence de traitement, elle va devenir importante et s’accompagner d’un épanchement de liquide intra-articulaire, et donc du gonflement des articulations et faire courir le risque de lésions articulaires. Le fait de pouvoir l’analyser directement et simplement avec l’échographie est donc une grande révolution diagnostique. D’autant qu’il est possible de combiner cette échographie avec un examen doppler qui analyse les flux de sang dans la synovite : plus les flux de sang sont importants, plus l’activité de la synovite est importante.
L’échographie est ainsi devenue l’examen fondamental du diagnostic et de la surveillance d’une polyarthrite rhumatoïde. Lors du diagnostic, l’échographie est plus sensible que l’examen clinique. Lors de la surveillance du traitement, la régression de l’épaisseur et du nombre des synovites, ainsi que la régression de l’activité vasculaire de ces synovites au doppler signe l’efficacité du traitement. A l’inverse, lors de la diminution, voire de l’arrêt du traitement, la réapparition de synovites en échographie signe la reprise de la maladie et justifie de la mise en route du traitement.
Qu’est-ce que le facteur rhumatoïde et les anticorps anti-CCP ?
Le facteur rhumatoïde est une protéine présente dans le sang de 80 % des personnes souffrant d’une polyarthrite rhumatoïde. Mais il est retrouvé également dans de nombreuses autres maladies (cirrhose hépatique, grippe…). Il n’a donc pas valeur de diagnostic, 20 % des PR n’ayant pas de facteur rhumatoïde. Les anticorps anti-CCP ou anti-peptides citrullinés (autrefois appelés anti-kératine) sont beaucoup plus spécifiques de la maladie. Sa présence n’est cependant pas systématique et il existe d’authentiques polyarthrites rhumatoïdes qui n’ont pas d’anticorps anti-CCP, voire même aucun facteur rhumatoïde. On les appelle parfois « polyarthrites rhumatoïdes séronégatives ».
Les anticorps anti-CCP ont également une valeur pronostique, car leur présence chez un malade serait associée à un risque de lésions articulaires plus important. Dans la mesure où les anticorps anti-CCP sont parfois présent très tôt dans le cours évolutif de la maladie, cette « positivité » aux anti-CCP est donc très importante pour choisir une stratégie thérapeutique incluant les médicaments les plus efficaces d’emblée.
En dehors des articulations, comment se manifeste la PR ?
La polyarthrite rhumatoïde s’accompagne parfois de fatigue et de fièvre qui sont le plus souvent modérées. Des atteintes de la peau peuvent aussi apparaître, le plus souvent aux coudes sous forme de "boules" perceptibles sous la peau ; on les appelle nodules rhumatoïdes. Dans 20 % des cas, les malades notent une sensation de sécheresse oculaire et parfois même buccale, correspondant à un syndrome sec associé qui est lié à une autre maladie auto-immune surajoutée : le syndrome de Gougerot-Sjögren.
Plus tardivement dans le cours évolutif de la maladie, la maladie auto-immune peut déborder de l’articulation et atteindre d’autres tissus de l’organisme, notamment par une inflammation des petits vaisseaux sanguins conduisant à une vascularite. Il est également possible de voir apparaître une atteinte de la charnière située entre la tête et la colonne cervicale, celle-ci pouvant conduire à une mobilité anormale et à un risque de lésions ou de compression de la moelle épinière. L’apparition de douleur du cou doit donc faire consulter un médecin. D’autres complications sont également possibles : infections, lymphomes (du fait du désordre du système de défense immunitaire), athérosclérose évolutive, atteinte rénale (du fait de l’inflammation persistante) et ostéoporose avec risque de fractures.
Quelle est la stratégie actuelle du traitement de la PR ?
Un traitement efficace, c’est-à-dire qui agit réellement sur le cours évolutif de la maladie, doit être débuté dès que le diagnostic est posé. L’objectif de ce traitement est d’obtenir une rémission, ou une faible activité de la maladie, le plus rapidement possible. C’est ce qui permet de protéger au maximum les articulations, d’éviter que leur état se dégrade.
Cette rémission doit être mesurée grâce à un score d’activité validé, le plus connu et utilisé étant le DAS (Disease Activity Score) qui est un score européen basé sur une évaluation articulaire clinique, une mesure de l’inflammation biologique et une appréciation de son état général par le malade.
Les médecins pourront ainsi calculer et recalculer un DAS pour analyser l’évolution d’une PR et évaluer objectivement l’efficacité de sa prise en charge. Mais le DAS devient maintenant un outil que les patients eux-mêmes peuvent utiliser pour surveiller leur maladie (projet METEOR).
Dans cette perspective, l’activité d’une PR doit être étroitement et régulièrement surveillée (tous les trois mois, voire plus souvent en phase d’activité de la maladie) et le traitement doit être étroitement ajusté à cette évaluation, jusqu’à ce que les objectifs thérapeutiques soient atteints ("Treatment-to-target"). Cette stratégie a clairement démontré son bénéfice et doit désormais être suivie.
De quels médicaments dispose-t-on pour soigner la PR ?
Le traitement médicamenteux précoce est fondamental au cours de la polyarthrite rhumatoïde. Il repose sur deux groupes de médicaments. Certains agissent uniquement sur les signes de la maladie (douleur, inflammation), mais ne modifient pas le cours évolutif de celle-ci : ce sont des "traitements symptomatiques", essentiellement les médicaments contre la douleur (les antalgiques) et les anti-inflammatoires non-stéroïdiens. Le traitement de la PR repose surtout sur des médicaments qui vont agir sur le cours évolutif de la maladie, différer l’évolution de la PR elle-même, voire la mettre en rémission : ce sont les "traitements de fond". Ils sont de deux types : les traitements de fond traditionnels, dits "de synthèse", qui agissent globalement sur le trouble immunitaire, et des traitements de fond biologiques, ou "biothérapies", qui agissent spécifiquement sur un mécanisme précis au sein même du système immunitaire. La place des corticoïdes est à part : ils agissent immédiatement sur l’inflammation et pourraient s’assimiler aux traitements symptomatiques, mais certaines études ont démontré leur intérêt sur le cours évolutif de la maladie, en particulier à la phase de début, où ils sont très utiles pour contrôler l’évolution des lésions articulaires en association avec un traitement de fond, en attendant leur efficacité.
Parmi les traitements de fond de synthèse, le méthotrexate (MTX) doit être intégré dans la stratégie thérapeutique de départ chez les patients qui ont une polyarthrite rhumatoïde active : c'est le traitement pivot de la PR, c'est-à-dire le traitement à partir duquel le médecin va construire toutes les stratégies. En cas de contre-indication ou de mauvaise tolérance au MTX, les autres traitements de fond de synthèse suivants peuvent être utilisés : sulfasalazine, leflunomide et sels d’or injectables.
Comment utilise-t-on les différents traitements de fond ?
Les différentes stratégies thérapeutiques font l’objet de recommandations professionnelles françaises et communes à l'Europe et aux Etats-Unis. Ces recommandations sont basées sur les résultats des études validées et sur leur analyse par les meilleurs experts réunis au sein de sociétés savantes. Elles font l’objet de réévaluations régulières.
Chez les patients n’ayant jamais reçu de traitement de fond, un traitement de fond utilisé seul doit être préféré à une association de traitements de fond de synthèse et le méthotrexate est le traitement de référence des maladies actives.
Chez les polyarthrites rhumatoïdes n’ayant jamais reçu de traitement de fond et qui ont des facteurs de mauvais pronostic (présence de facteur rhumatoïde et/ou d’un anticorps anti-CCP, maladie rapidement érosive, évolutive, activité de la maladie forte), une association comprenant méthotrexate et biothérapie d’emblée peut être envisagée.
Si l’objectif thérapeutique n’est pas atteint avec le premier traitement de fond, l’association d’un traitement de fond biologique au méthotrexate doit être envisagée en présence de facteurs de mauvais pronostic. En l’absence de facteurs de mauvais pronostic, le remplacement du premier traitement par un autre traitement de fond de synthèse peut être envisagé.
Chez les polyarthrites rhumatoïdes répondant de façon insuffisante au méthotrexate et/ou à un autre traitement de fond de synthèse, un traitement de fond biologique doit être débuté assez rapidement. L’expérience et les pratiques actuelles sont en faveur d’une association méthotrexate et anti-TNF.
Les patients qui ont eu un échec à un premier traitement anti-TNF doivent recevoir un autre anti-TNF ou plutôt une biothérapie d’une autre classe : de l’abatacept, du rituximab ou du tocilizumab... et bientôt d'autres classes. Il n'y a pas réellement de guide pour choisir entre ces traitements, sauf pour le rituximab qui serait plus indiqué en cas de fort taux d'auto-anticorps (en pratique, le rituximab est plutôt employé en 3e ou 4e ligne, ou en cas de fibrose pulmonaire.
En cas de polyarthrite rhumatoïde réfractaire sévère ou de contre-indications aux biothérapies ou à un traitement de fond déjà mentionné, d’autres traitements de fond de synthèse peuvent être envisagés : azathioprine, ciclosporine A, cyclophosphamide.
En cas de rémission persistante, la corticothérapie doit être réduite, puis on peut envisager de réduire et d'arrêter le traitement de fond biologique ; en particulier si celui-ci est associé à un traitement de fond de synthèse (on garde le traitement de fond de synthèse). En cas de rémission prolongée et complète, une réduction prudente du traitement de fond de synthèse peut également être envisagée, et la décision doit être partagée entre le patient et le médecin. En cas de reprise évolutive de la maladie, le traitement qui a conduit à la rémission sans traitement est généralement efficace.
Qu’est-ce qu’une rémission et une faible activité de la maladie ? A quoi sert le DAS ?
L’objectif principal du traitement de la polyarthrite rhumatoïde est donc de mettre le malade en rémission ou, à défaut, de n’autoriser qu’une activité de la maladie la plus minime possible.
Après un traitement débuté par un seul traitement de fond de synthèse, l’escalade thérapeutique est aujourd’hui rapide, avec l’utilisation d’associations de traitements de fond classiques dans les formes modérées (dont une corticothérapie initiale) et le recours aux biothérapies dans les formes les plus agressives de la maladie.
Un élément fondamental est donc de disposer d’une évaluation fiable de l’évolutivité de la maladie afin d’ajuster au mieux la stratégie thérapeutique en fonction de l’état du malade et de la réponse thérapeutique. Cette stratégie est définie en fonction du niveau du score d’activité clinique, le DAS (Disease Activity Score), évalué tous les 3 mois.
Le DAS est donc basé sur une évaluation de deux critères cliniques (la douleur et le gonflement articulaire) à partir de l’examen de 44 (DAS44) ou de 28 articulations (DAS28), d’un critère d’inflammation biologique (le plus souvent la vitesse de sédimentation ou VS) et d’un critère d’auto-évaluation de son état général par le malade (en fonction d’une échelle visuelle analogique graduée de 0 mm = meilleur état possible à 100 mm = pire situation possible). Le DAS est le résultat d’un calcul mathématique réalisé à partir de ces quatre critères.
Pour un DAS calculé à partir des 28 articulations les plus souvent concernées (mains, poignets, coudes, épaules et genoux), la rémission est définie par un score de DAS28 inférieur à 2,6. Une faible activité de la maladie est définie par une valeur du DAS28 comprise entre 2,6 et 3,2. Une activité modérée correspond à une valeur comprise entre 3,2 et 5,1 et une activité élevée de la maladie rhumatoïde est supérieure à 5,1.
A quoi sert la cortisone ?
La cortisone a une action antalgique immédiate, ainsi qu’une action anti-inflammatoire. De plus, il est évoqué qu'un traitement quotidien par faibles doses de cortisone, administrées en comprimés pendant 2 ans au début d’une polyarthrite rhumatoïde, pourrait freiner (voire éviter) les lésions des articulations atteintes.
Il existe donc plusieurs manières d'utiliser la cortisone. Pour certains, il ne faut l'utiliser qu'en cas de maladie douloureuse et/ou inflammatoire et l'arrêter dès lors que la maladie s'améliore (rémission). Pour d'autres, il est conseillé de poursuivre une petite dose de cortisone même si les douleurs régressent : on l'utilise alors comme un véritable traitement de fond.
Le point réellement essentiel est la dose quotidienne. Celle-ci doit être la plus basse possible (si possible inférieure à 0,1 mg/kg/jour) afin d’améliorer le confort des malades et de minimiser le risque de complications à long terme. Un des objectifs du traitement de fond est d’arrêter progressivement les corticoïdes après mise en rémission. Cet objectif est désormais plus facilement atteignable avec les biothérapies, mais certains experts considèrent qu’il est possible de garder une corticothérapie de 1 à 3 mg par jour dans les formes les plus sévères, si le malade se sent mieux avec ce traitement. Même à ces très faibles doses, les corticoïdes ont une activité immunomodulatrice et sont efficaces : ils améliorent souvent le confort et évitent de prendre des anti-inflammatoires non-stéroïdiens à trop forte dose, ces derniers n'étant pas sans risque en prise prolongée.
La voie d'administration habituelle reste la voie orale, en ayant recours à des comprimés. La voie intraveineuse habituellement utilisée est la perfusion. Le principe est d'administrer en quelques heures (2 à 3 h) une grande quantité de cortisone (généralement 7 à 15 mg/kg de cortisone) afin d'avoir un effet antalgique anti-inflammatoire et immunomodulateur immédiat très important (sans avoir les effets néfastes de ce type de traitement s'il était administré par la bouche à dose équivalente). L'effet de ce traitement dure de quelques semaines à quelques mois après la perfusion. C'est la raison pour laquelle il est parfois proposé à des patients souffrant d’une maladie très douloureuse et inflammatoire. Il nécessite toutefois des précautions particulières, ce qui justifie son administration en hospitalisation.
Qu’est-ce qu’une biothérapie ?
La mise à la disposition des médecins et des patients des traitements de biothérapie représente un progrès majeur dans la prise en charge de la polyarthrite rhumatoïde. La meilleure connaissance de notre système immunologique et notamment des mécanismes qui aboutissent à la fabrication des anticorps, qui sont capables de bloquer une substance particulière dans l’organisme, sont à l'origine de ces avancées thérapeutiques. On est maintenant capable de demander à des cellules cultivées en laboratoire de fabriquer des anticorps, semblables à ceux de l’homme, dirigés sur une cible particulière, ou des anti-récepteurs de ces anticorps. La cible est généralement une substance, ou une cellule, qui est activée en excès dans la maladie (par exemple le TNF, l'IL6...).
Les biothérapies sont des traitements plus efficaces que les traitements de fond de synthèse et généralement mieux tolérés car elles ne bloquent pas l’ensemble du système immunitaire. Elles ciblent spécifiquement les protéines de l’inflammation (TNF-alpha, interleukine-6 et plus récemment, interleukine-12/23) : ce sont les biothérapies de 1ère génération appelées anti-TNF alpha, anti-IL-1 ou anti-IL-6.
D’autres types de médicaments ciblent les cellules de l’inflammation, les lymphocytes : ce sont les biothérapies de 2e génération. Actuellement, il est possible de disposer d’anticorps anti-CD20, une protéine qui est exprimée exclusivement à la surface des lymphocytes B, ce qui aboutit à la destruction transitoire de ces cellules. Il existe d’autres molécules qui vont cibler spécifiquement un facteur essentiel au transfert d’informations entre les lymphocytes T et les lymphocytes B.
Dernièrement, on voit arriver ce que l’on peut appeler les biothérapies de 3e génération : ce sont de petites molécules qui visent à bloquer certaines enzymes intracellulaires qui participent au mécanisme d’activation de l’inflammation ; on les appelle également inhibiteurs des voies de signalisation (anti-JAK).
Que faire en cas d’échec à une biothérapie ?
La recherche menée durant la dernière décennie a produit autant de nouvelles molécules actives contre la polyarthrite rhumatoïde que pendant les 30 dernières années et ces molécules sont beaucoup plus spécifiques et plus puissantes. Différents mécanismes sont ciblés par ces molécules et, en cas d’échec à une biothérapie, il apparaît plus intéressant de changer de cible thérapeutique pour atteindre l’objectif thérapeutique. Les patients qui ont eu un échec à un premier traitement anti-TNF doivent donc recevoir une autre biothérapie qui peut être de l’abatacept, du rituximab ou du tocilizumab.... Une recherche est en cours afin de déterminer quelles sont les stratégies thérapeutiques les plus adaptées aux différents profils des malades et de nouvelles molécules ciblant de nouveaux mécanismes apparaissent presque chaque année.
En cas de polyarthrite rhumatoïde réfractaire aux biothérapies, d’autres traitements de fond de synthèse peuvent être envisagés : azathioprine, ciclosporine, cyclophosphamide. Ceux-ci sont utilisables seuls ou en association avec d’autres traitements de fond. En dehors de ces molécules, d’autres traitements non conventionnels restent possibles.
Le traitement de la PR est-il à vie ou peut-on l’arrêter ?
La rémission de la maladie est beaucoup plus fréquente avec les traitements de biothérapie, comme avec les stratégies d’escalade de dose accélérée des traitements de fond de synthèse, que par le passé.
Actuellement, il est possible d’atteindre cet état de rémission dans 40 à 50 % des cas si le traitement est mis en œuvre rapidement et qu’il est ajusté exactement en fonction de l’activité de la maladie et de l’état inflammatoire. Dans ces conditions, se pose la question du maintien du traitement au-delà d’un certain délai de temps passé en rémission. Ce délai, ainsi que les modalités d’interruption du traitement, ne sont actuellement pas connus avec précision et différentes recherches sont menées pour le déterminer.
Selon les recommandations européennes, en cas de rémission complète et prolongée, une réduction progressive du traitement de fond peut être envisagée, la décision devant être partagée entre le patient et le médecin. La corticothérapie doit être réduite en premier, puis on peut envisager de réduire le traitement de fond de biothérapie, puis le traitement de fond de synthèse.
Quels sont les traitements locaux disponibles ?
Les infiltrations (injections de cortisone dans l'articulation) sont un traitement très efficace pour lutter contre l'inflammation locale, source de douleurs et de déformations. L'indication préférentielle de l'infiltration est la persistance de l'inflammation d'une ou de quelques articulations. Il paraît en effet plus judicieux (plus efficace et moins risqué) d'administrer l'anti-inflammatoire par voie locale plutôt que par voie générale. Le problème est de savoir combien d'articulations peuvent être infiltrées en une seule séance, combien d'infiltrations peuvent être effectuées par an (sans risque important) et quel délai minimum respecter entre deux infiltrations. En fait, il n'y a pas de règle précise : il est habituel de ne pas dépasser trois à quatre infiltrations par articulation et par an. Pour augmenter et prolonger l'efficacité de l'infiltration, il est fortement recommandé de mettre l'articulation infiltrée au repos pendant 48 heures pour limiter le plus possible la diffusion du corticoïde en dehors de l’articulation.
La persistance d'une inflammation locale de l'articulation, après échec d'une ou de plusieurs infiltrations, est l'indication habituelle des synoviorthèses. La synoviorthèse consiste en l'injection intra-articulaire d'un produit capable de détruire les cellules de la synoviale qui se sont multipliées en excès. Le produit utilisé (souvent radioactif) dépend de l’articulation et des moyens techniques disponibles. Tous ces produits sont administrés en intra-articulaire strict sous contrôle radiographique.
Les synoviorthèses doivent être considérées comme un geste technique spécialisé devant être réalisé dans un centre expérimenté : nécessité absolue d'injecter le produit dans la cavité articulaire, de surveiller les doses reçues de rayonnement radioactif.
Qu’est-ce qu’une synovectomie ?
Le principe de la synovectomie est le même que celui d'une synoviorthèse, c’est-à-dire de détruire les cellules synoviales qui se sont développées en excès à l'intérieur de l'articulation, en les enlevant par voie chirurgicale. Pour les éliminer, on peut soit ouvrir l'articulation en effectuant une intervention chirurgicale (on parle alors de synovectomie chirurgicale), soit préférer une intervention plus limitée sans "ouvrir" l'articulation, mais en s'aidant d'un arthroscope, petit tuyau qui permet de pénétrer dans l'articulation, de voir à l'intérieur et d'enlever la synoviale anormale (on parle alors de synovectomie arthroscopique). Les synovectomies les plus fréquemment proposées intéressent le genou et le poignet.
Quelle est la place de la chirurgie ?
La chirurgie a transformé le pronostic de la polyarthrite rhumatoïde en permettant de recouvrer une activité perdue en cas de polyarthrite destructrice. La chirurgie peut également aider à prévenir des destructions cartilagineuses ou tendineuses. Les progrès des stratégies thérapeutiques et l’introduction des biothérapies ont nettement réduit le recours à la chirurgie qui est devenue de moins en moins fréquente.
La chirurgie a deux indications. D'une part, aider à la suppression de la prolifération synoviale. Dans ce cas, le but est d'agir précocement, c'est-à-dire avant que cette prolifération synoviale n'ait entraîné des lésions irréversibles du cartilage ou des tendons. C'est la synovectomie. D'autre part, restaurer une fonction définitivement perdue. Dans ce cas, le but est d'intervenir lorsque les tendons sont rompus ou le cartilage détruit. On peut avoir recours soit à une réparation tendineuse, soit à un remplacement articulaire par une prothèse, soit, enfin, lorsque l'implantation d'une prothèse est impossible, au blocage d'une articulation détruite et douloureuse (arthrodèse) dans une position qui permettra l'absence de douleur.
Quelle est l’efficacité de la rééducation et de la réadaptation fonctionnelle ?
La polyarthrite rhumatoïde est un rhumatisme inflammatoire : les médicaments calment l'inflammation et freinent l'évolution de la maladie. Néanmoins, l'inflammation fragilise les articulations qui deviennent moins solides et tendent à se déformer. Le but de la rééducation est de protéger les articulations et de réduire les conséquences mécaniques du rhumatisme, tout en conservant une activité aussi normale que possible.Son action complète celle des médicaments.
Pendant les poussées inflammatoires, il est conseillé de mettre les articulations inflammatoires au repos. Des contractions dites isométriques, c'est-à-dire sans déplacement de l'articulation, quelques minutes par jour, permettent de lutter contre la fonte musculaire.
En dehors des poussées, le kinésithérapeute pourra proposer des exercices dynamiques, contre résistance.
Le patient doit être informé, éduqué, pour bien gérer le traitement physique au même titre que le traitement médicamenteux. Cela demande de la persévérance. Il est en effet plus difficile de prendre de bonnes habitudes d'activités physiques que d'ingérer des médicaments tous les jours, mais les efforts réguliers et durables sont récompensés.
A quoi sert l’ergothérapie ?
Dans l'ergothérapie, on utilise l'activité comme moyen thérapeutique. En fait, l'ergothérapie, en rhumatologie, regroupe l’éducation gestuelle, la rééducation par l'activité, la confection de petits appareillages et la réadaptation.
Il faut apprendre la meilleure façon d'effectuer les activités de la vie quotidienne tout en protégeant les articulations fragilisées par la maladie. On parle souvent "d'économie articulaire", ce qui ne signifie absolument pas qu'il ne faut plus rien faire pour économiser ses articulations ! L'ergothérapeute peut aider la malade à améliorer son environnement, en lui donnant des conseils pour aménager sa maison, en lui indiquant des ustensiles spéciaux appelés dans le langage médical "aides techniques" qui permettent de faire simplement des choses devenues difficiles à effectuer comme tourner un robinet, ouvrir un bocal ou une porte.
La rééducation en ergothérapie s'effectue aussi par le biais d'exercices manuels ou d'activités artisanales, le but étant d'entretenir les articulations et la musculature au cours d'une activité ludique indolore. L'ergothérapeute observe les difficultés puis corrige postures et gestes.
Enfin, l'ergothérapeute confectionne des orthèses ou attelles pour améliorer la réalisation des activités (orthèses de fonction) ou la qualité du repos articulaire (orthèse de repos). Les orthèses peuvent être de série ou faites sur mesure. Elles sont confectionnées dans des matériaux rigides (thermoplastiques) ou semi-rigides (résine, tissus). La plupart des orthèses rigides, en particulier les orthèses des mains, sont confectionnées avec des matériaux thermoplastiques qui sont malléables à basse température et plus légers que le plâtre. Ces orthèses sont légères, bien adaptées, confortables, ajustables, relativement esthétiques et faciles à entretenir.
L'ergothérapie est un métier enseigné dans des écoles spécialisées. Il existe peu d'ergothérapeutes en dehors des hôpitaux et des centres de rééducation. On peut obtenir les conseils d'un ergothérapeute en parlant au rhumatologue, en contactant directement certaines structures associatives ou en sollicitant les services sociaux de la mairie. Les soins d'ergothérapie sont toujours prescrits par le médecin. En cas d’hospitalisation, les actes d'ergothérapie sont compris dans le prix de journée.
Que penser de l’homéopathie, de l’acupuncture et des plantes médicinales ?
L'homéopathie utilise les mêmes produits de base que la médecine traditionnelle, mais en très faible quantité. Des études scientifiques correctement conduites ont conclu à son inefficacité, c'est-à-dire à l'absence de supériorité d'un traitement homéopathique par rapport à un traitement placebo. Ceci n'empêche toutefois pas nombre de malades d'y avoir recours. Ces traitements ne semblent pas toxiques.
Comme l'homéopathie, l'acupuncture n'a pas démontré son efficacité dans la polyarthrite rhumatoïde. Elle ne modifie en rien l'évolution naturelle de la maladie, mais chez certains malades, elle pourrait éventuellement contribuer à la diminution des douleurs. Le risque de cette technique est celui d'une irritation locale et d'une contamination par le virus de l'hépatite et du VIH en cas de non-utilisation d'aiguilles à usage unique par l’acupuncteur.
Aucun traitement avec des plantes médicinales n'a fait la preuve de son efficacité dans la polyarthrite rhumatoïde. Il ne faut pas croire que les propriétés dites naturelles des plantes signifient "douceur" ou encore "innocuité". Des accidents très sévères, altérant le fonctionnement du foie et des reins, ont même été décrits après ingestion de tisanes faites à partir de certaines herbes chinoises non contrôlées.
Quel est l’intérêt des cures thermales ?
Les cures thermales (crénothérapie) utilisent des eaux, des vapeurs ou des boues thermales. Leur efficacité dans la polyarthrite rhumatoïde est controversée. Les effets thérapeutiques, s'ils existent, tiendraient à leur composition chimique et à leur température.
Le bénéfice de la cure n'est pas seulement (et même probablement pas) dû aux propriétés des eaux thermales. Il peut être bon de s'éloigner pendant quelques temps de son environnement habituel : cette "cassure" permet de prendre du recul face à ses difficultés quotidiennes. D'autre part, la cure se déroule dans un lieu privilégié pour se reposer, s'occuper de soi, sans se retrouver dans un contexte médical oppressant. Enfin, dans de nombreux endroits, les thérapeutiques thermales sont intégrées dans un programme d'éducation et de rééducation de la maladie rhumatoïde dans son ensemble, avec éventuellement une prise en charge diététique.
La cure thermale dure environ trois semaines. Elle doit être prescrite par un médecin. Il faut choisir impérativement un centre homologué et suivre la cure en totalité (18 jours minimum) pour bénéficier du remboursement. Pour les malades dont la polyarthrite rhumatoïde est acceptée comme affection de longue durée (ALD), ils bénéficient d'un remboursement à 100 % des frais médicaux sur la base des tarifs conventionnels. Les frais d'hébergement sont également remboursés à 100 % sur la base d’un forfait de 150,01 euros et les frais de transport sur la base du tarif SNCF 2ème classe.
Faut-il suivre un régime alimentaire particulier ?
Les différents essais menés ne sont pas en faveur d'une modification du régime alimentaire. Le gluten n'est pas lié à la polyarthrite rhumatoïde. Certains malades ont l'impression qu'en retirant certains aliments, ils vont mieux, mais aucune étude contrôlée ne l'a confirmé et ce genre de démarche aboutit généralement à des restrictions alimentaires néfastes.
Il est vrai qu'arrêter complètement de s'alimenter peut induire une amélioration, mais on ne sait pas comment cela marche et cette stratégie n'est évidemment pas tenable sur le long terme. Si vraiment vous avez plusieurs fois introduit et retiré un aliment de votre alimentation avec un effet identique à chaque fois, parlez-en à votre médecin, mais le plus sûr est d'avoir un régime équilibré.
Quels traitements pendant la grossesse ?
La grossesse est possible et même souhaitable chez les femmes souffrant de polyarthrite rhumatoïde et cette question doit être systématiquement abordée avec le médecin du fait des conséquences de certains médicaments sur la grossesse.
Tout d’abord, il faut rappeler que tous les anti-inflammatoires non-stéroïdiens (AINS) sont traditionnellement mauvais au cours de la grossesse, surtout au cours du premier et du dernier trimestre. Par ailleurs, il faut savoir aussi que les AINS avec une forte activité anti-COX2 (ou Coxibs) perturbent la nidification. Il faut donc savoir les arrêter si les femmes veulent un enfant et ils sont contre-indiqués chez les femmes en âge de procréer sans contraception.
Le méthotrexate est le traitement de fond de référence, mais il est clairement à l’origine de malformations (tératogène). Il doit donc être interrompu avant toute conception (sur le cycle antérieur au cycle souhaité de grossesse). En pratique, il suffit de l’arrêter en même temps que la contraception.
A noter que chez l’homme, du fait de la longueur de la spermatogénèse, il convient d’arrêter le méthotrexate au moins 3 mois avant la conception.
Concernant les autres traitements de fond traditionnels (dits de synthèse), la situation n’est pas du tout homogène. Le léflunomide est formellement contre-indiqué pendant la grossesse et il doit être arrêté au moins 2 semaines avant la conception parallèlement à la prise de cholestyramine ou de charbon actif.
La sulfasalazyne (SZP) est un traitement parfaitement accepté. L’azathioprine est également autorisée. En ce qui concerne l’hydroxychloroquine, non seulement cette molécule est autorisée, mais elle est même recommandée par similarité avec le lupus où des bénéfices ont été démontrés sur la grossesse.
Pour les biothérapies, là aussi la situation est contrastée. Pour les anti-TNF, les premiers des traitements biologiques, c’est désormais parfaitement clair. La conception est autorisée sous anti-TNF et les femmes peuvent être traitées pendant toute la grossesse avec un anti-TNF alpha. Deux 2 molécules sont particulièrement bien étudiées, l’étanercept et le certolizumab pegol avec lesquels il n’y a que peu ou pas de passage transplacentaire. Il est donc possible d’envisager une monothérapie par anti-TNF pour permettre une amélioration clinique et une réduction de l’inflammation qui favorisera la conception chez la femme jeune.A noter que pour l’homme il y a encore des recommandations de prudence et il est encore conseillé d’arrêter les anti-TNF au moins 3 mois avant la conception.
Pour les autres biologiques, tels que anti-IL6, inhibiteurs de la co-stimulation, et cetera…, on a moins de données et ils restent déconseillés avec au maximum l’interruption du traitement par le rituximab au moins 6 mois avant la conception.
En cas de doute sur une éventuelle interaction d’un médicament avec la grossesse, il est possible de se reporter au site du CRAT, le centre de référence sur les agents tératogènes, celui-ci regroupe toutes les données sur la grossesse
http://www.lecrat.org/
Doit-on se faire vacciner ?
Pour tous les patients, la vaccination antitétanique est fortement recommandée. Pour les personnes fragiles ou à risque, les vaccinations anti-pneumococcique, anti-grippale et anti-hépatite B sont également conseillées. Il est recommandé de se faire vacciner, quand cela est possible, avant de débuter un traitement immuno-modulateur comme le méthotrexate ou les biothérapies et de discuter avec son médecin avant toute vaccination particulière. La vaccination contre la fièvre jaune par exemple ne doit pas être réalisée au cours d’un traitement immunosuppresseur.
Doit-on maintenir son activité ou la réduire ?
Quand on a une polyarthrite rhumatoïde, il faut prendre plus que quiconque de bonnes habitudes, c'est-à-dire s'efforcer de conserver une activité physique suffisante et poursuivre cette activité tout en évitant de solliciter inutilement les articulations, en particulier au moment des poussées de la maladie.
Avoir une activité physique régulière, c'est marcher, faire du vélo ou nager à son rythme. Si les douleurs sont réveillées lors d’une activité, il ne faut pas se décourager mais plutôt attendre la rémission, et peut-être qu'en s’équipant mieux ou en changeant certains gestes, il sera possible de continuer. Il est également conseillé de faire une courte séance de gymnastique quotidienne. La gymnastique des mains peut préserver la souplesse des articulations des doigts et des poignets. Celle des jambes permet d'entretenir la force des muscles qui assurent une position debout solide et une marche assurée.
Il faut aussi poursuivre autant que possible les activités quotidiennes ménagères et professionnelles en aménageant l’environnement pour réduire les efforts. Par exemple, le choix judicieux des équipements électroménagers et des robinets (avec mitigeur par exemple) facilite les activités ménagères. Il faut aussi apprendre à éviter les gestes nocifs et les remplacer par des gestes qui épargnent davantage les articulations. De plus, il ne faut pas hésiter à se munir d’ustensiles simples qui éviteront des efforts inutiles. Citons par exemple l‘ouvre-boîte électrique ou les ciseaux à ressort. L'ergothérapeute a la compétence pour faire cette éducation gestuelle et favoriser la découverte des ustensiles utiles pour être actif tout en ménageant les articulations.
Au cours d’une poussée inflammatoire, peut-on faire de la rééducation ?
Au cours d'une poussée, il faut mettre au repos les articulations atteintes. En effet, l'inflammation qui se traduit par des douleurs et un gonflement articulaire fragilise l'articulation qui risque de se déformer avec les efforts. Il faut donc prendre certaines précautions en attendant que les médicaments agissent.
L'articulation enflammée doit être sollicitée le moins possible pendant la journée et mise au repos en position correcte la nuit. La bonne position n'est pas celle qui réduit le plus les douleurs, elle doit d'abord préserver la fonction, c'est-à-dire éviter l'enraidissement invalidant de l'articulation. Pour la même raison, il est aussi souhaitable de maintenir en bonne position l'articulation quelques minutes plusieurs fois par jour. Si les douleurs sont importantes malgré les médicaments, l'application de froid (vessie de glace) peut soulager. Prenons l'exemple du genou : quand on a une atteinte douloureuse avec gonflement du genou, on est tenté de glisser dans son lit un coussin sous le genou pour calmer les douleurs. Or, ceci est néfaste car le genou risque de s'enraidir en flexion et cette déformation, qui compromet la marche, est difficile à corriger une fois la poussée terminée. Les mains et les poignets doivent également être immobilisés en bonne position quand les articulations sont inflammatoires. On recommande alors de porter au moins la nuit des orthèses de repos moulées. Ces appareils immobilisent les articulations du poignet et des doigts en position de fonction tout en réduisant la traction des tendons. Leur effet sur les douleurs et l'inflammation est rapide.
Attention ! Mettre au repos les articulations inflammatoires ne signifie en aucun cas rester dans un lit ou dans un fauteuil toute la journée. Il faut continuer à s'activer même si on est fatigué, pour éviter les effets néfastes d'une immobilisation prolongée.
Peut-on avoir des enfants ?
La polyarthrite rhumatoïde n'influence pas la grossesse. En d'autres termes, il n'y a pas plus de stérilité chez les femmes ayant une PR, et en cas de grossesse, il n'y a pas plus de fausses couches spontanées, d'accouchement prématurés, ni de malformations fœtales. Il a même été constaté que, souvent, la grossesse améliorait la maladie, une amélioration qui s’estompe rapidement après l’accouchement.
Cependant, beaucoup des traitements administrés pour soigner la polyarthrite rhumatoïde peuvent avoir un effet sur la grossesse et sur le fœtus. Certains peuvent même entraîner des malformations du fœtus et doivent donc être interrompus avant le début de la grossesse. C’est pourquoi les rhumatologues conseillent d’attendre une rémission de la maladie, puis arrêtent la plupart des traitements, y compris les anti-inflammatoires non-stéroïdiens. Ils mettent généralement en route une corticothérapie à dose faible pour éviter une rechute précoce de la maladie. La grossesse se déroule alors normalement et le traitement habituel est repris après l’accouchement, sans attendre la réapparition des douleurs ou plus tard, en particulier si l’enfant est nourri au sein.
Peut-on allaiter ?
Les avantages de l’allaitement semblent bien supérieurs aux potentiels et rares inconvénients. En fait, le bénéfice physique pour l'enfant et psychologique pour la mère sont plus importants que le risque d'une poussée de la maladie due à cet allaitement.
Le problème réside dans le risque du passage des médicaments pris par la mère dans le lait. En pratique, cela n'influe que sur la prise des traitements de fond avec, notamment, une contre-indication d'allaiter en cas de prise d’immuno-suppresseurs.
Quelle contraception utiliser ?
Tous les moyens contraceptifs peuvent être utilisés au cours de la polyarthrite rhumatoïde, y compris le stérilet. L'utilisation de médicaments anti-inflammatoires, qu'ils soient stéroïdiens ou non stéroïdiens, a la réputation de rendre le stérilet moins opérationnel mais ceci n'est pas démontré formellement. En cas d’inquiétude avec le stérilet, on peut y associer une contraception locale complémentaire pendant les phases ovulatoires.
Les contraceptions usuelles sont d’autant plus nécessaires que l’on est sous traitement et que la plupart de ces traitements doivent être arrêtés en cas de désir de grossesse car ils font courir un risque de malformations pour le bébé.
Faut-il suivre un régime alimentaire ?
Il faut insister sur le fait que ce domaine fait l'objet de nombreuses affirmations et publicités dénuées de tout fondement, voire carrément mensongères. Les arguments sont toujours séduisants, mais reposent rarement sur des bases scientifiques. En fait, il n'existe pas de régime alimentaire standard pour tous les patients et il n'existe pas non plus de régime miracle. Cependant, il est nécessaire de respecter certaines règles diététiques et il est souhaitable, au moins une fois, de prendre l'avis auprès d'un spécialiste de la nutrition.
Au cours de la polyarthrite rhumatoïde, on observe une fonte musculaire et une ostéoporose (fragilité osseuse pouvant aboutir à la survenue de fractures) qui peuvent être dues à l'inflammation, à l'inactivité, ainsi qu'au traitement par la cortisone à trop forte dose. Une alimentation particulière peut contribuer à prévenir ces complications ou même à restaurer un bon état musculaire et osseux. Une alimentation équilibrée avec un régime alimentaire riche en calcium et un apport suffisant en vitamine D contribuent à prévenir la fonte musculaire et l'ostéoporose, en complément d'une activité physique régulière.
Par ailleurs, un traitement par la cortisone à forte dose de manière prolongée peut être responsable de plusieurs troubles : hypercholestérolémie, diabète, baisse de potassium, hypertension artérielle et modifications de la répartition des graisses (aspect bouffi du visage). Dans ce cas, les moyens diététiques sont très utiles :
• Un régime peu salé, pour éviter la rétention d'eau et de sel observée avec la cortisone, prévenir l'hypertension artérielle et empêcher la fuite urinaire de calcium. Cependant, le régime sans sel strict n’est pas recommandé, sauf en cas de "forte dose" de cortisone.
• Un régime contrôlé en sucres simples et en produits sucrés (confitures, miel, confiseries, pâtisseries, jus de fruits, sodas...).
• Un régime pauvre en graisses animales (beurre, crème, charcuterie) au profit des graisses végétales (huiles et margarines).
En conclusion, on peut donner quelques conseils simples : avoir une alimentation équilibrée, ne pas jeuner et ne pas exclure systématiquement un aliment réputé allergique.
Est-il possible de travailler avec une PR ?
La réponse dépend bien sûr de la profession, et de l’état de santé du malade. Il est clair que les nouvelles stratégies thérapeutiques et les biothérapies ont amélioré de telle façon l’état des maladies les plus sévères, que l’absentéisme au travail en a été réduit. Cependant, on ne sait pas encore si les malades souffrant de polyarthrite rhumatoïde seront capables de travailler plus longtemps. Cela reste probable au vu de la réduction impressionnante des mises en place de prothèses articulaires que l’on a observé dans cette maladie au fur et à mesure que les biothérapies ont été introduites.
Globalement, si une personne se sent capable de travailler sans que ce soit au prix d'une surconsommation dangereuse de médicaments anti-inflammatoires, alors elle peut continuer. En cas de difficultés professionnelles, il ne faut pas prendre trop vite une décision radicale. Il peut être possible d'améliorer les conditions de travail et le médecin du travail de l'entreprise peut aider à le faire. Des aménagements simples peuvent suffire. Il faut essayez par exemple d'obtenir une modification des horaires de travail : en commençant la journée de travail plus tard dans la matinée, le dérouillage matinal se termine avant le début des activités. Il peut être aussi nécessaire de modifier les outils de travail.
En revanche, si le travail est incompatible avec la maladie, la solution n'est certainement pas de continuer à tout prix. Dans ce cas, il faut contacter une assistante sociale. Quitter un travail ne signifie pas nécessairement sortir de la vie active définitivement.
Que faire si travailler n’est plus possible ?
Si le travail devient trop pénible, le médecin peut prescrire un arrêt de travail, même prolongé, ce qui permet de ne pas prendre de décision à la hâte quant à son avenir professionnel. Dans le régime général, lorsque l’arrêt de travail est lié à une ALD (affection de longue durée comme la polyarthrite rhumatoïde), des indemnités journalières peuvent être versées pendant une durée maximale de 3 ans (un an pour les autres maladies), en continu ou en fractionné. L’indemnité journalière est égale à 50 % du salaire brut journalier, calculée sur les 3 derniers mois de salaire, avec un plafond maximum par jour. Dans la Fonction publique, un arrêt de travail lié à la PR ouvre droit au CLM (Congé Longue Maladie) indemnisé pendant un an à plein traitement et 2 ans à demi-traitement (3 mois dans le cas d’une maladie ordinaire). En cas de reprise du travail, des droits peuvent s’ouvrir à nouveau.
La situation peut ensuite évoluer de plusieurs façons :
• Soit ce n'était qu'un mauvais passage et les modifications du traitement ont permis de vaincre l’évolution ou la poussée de la maladie : la reprise du travail s’effectue normalement.
• Soit le malade va mieux, mais ne se sent pas capable de reprendre son travail au même rythme qu'avant. Le médecin peut proposer de reprendre le travail en mi-temps thérapeutique. Pendant cette période, le salaire est calculé sur le temps de travail effectué et une indemnité journalière est versée afin de compenser la perte de salaire occasionnée par la réduction d’activité. Dans la fonction publique, le mi-temps thérapeutique existe également et peut être utilisé à l’issue d’un CLM. Pour obtenir un mi-temps thérapeutique, il faut l'accord du médecin conseil et de l'employeur. Le mi-temps thérapeutique est une solution transitoire envisagée après un arrêt de travail de 3 mois au moins et dans l'attente d'une reprise d'activité à temps plein. Si cette situation s'éternise (plus de six mois environ), une mise en invalidité de première catégorie doit alors être envisagée. Dans la fonction publique, le mi-temps thérapeutique est limité à un an par affection ouvrant droit au CLM.
• Soit le malade n’est pas capable de reprendre le travail. Le médecin poursuivra l’arrêt de travail et on aboutira dans un délai variable (ne dépassant pas trois ans) à une demande d'invalidité auprès de la Sécurité Sociale. Elle peut être accordée au salarié dont l’état de santé réduit au moins des deux tiers sa capacité de travail ou d’au moins deux tiers ses revenus, sous réserve qu’il remplisse également des conditions administratives (moins de 60 ans et durée de cotisation suffisante).
La demande d’invalidité peut être effectuée si l’état de santé est stabilisé, ou en fin de droit d’indemnités journalières : dans ce cas, la proposition est faite par le médecin conseil de la CPAM (Caisse Primaire d’Assurance Maladie) qui va déterminer la catégorie d’invalidité dans laquelle le malade se trouve.
Quelles sont les associations de malades et quelle aide peuvent-elles apporter ?
Une association de malades regroupe, comme son nom l'indique, des malades désireux de s'unir pour lutter ensemble contre une maladie donnée.
Ci-dessous les coordonnées de quelques associations :
2, rue Bourgon - 75013 Paris
E-mail : aflar@wanadoo.fr
Site internet : www.aflar.org
9, rue de Nemours - 75011 Paris
Tél. : 01 400 30 200
Fax : 01 400 30 209
E-mail : afp@nerim.net
Site internet : www.polyarthrite.org
149, avenue du Maine – 75014 Paris
N°Vert : 0800 001 159
E-mail : mailto:andar.polyarthrite@wanadoo.fr
Site internet : www.polyarthrite-andar.com
9, rue de Nemours - 75011 Paris
Tel : 01 40 03 03 02
E-mail : contact@kourir.org
Site internet : www.kourir.org
Il faut savoir que faire partie d'une association à trois grands intérêts :
• Renforcer l'image de la maladie vis-à-vis des pouvoirs publics. En d'autres termes, plus la représentation de ces associations est grande, plus la maladie est reconnue par les pouvoirs publics, plus des attributions (moyens financiers, reconnaissance sociale...) lui seront accordées ;
• Informer les patients à l’aide de brochures, réunions, échanges de courrier et permanence téléphonique ;
• Pouvoir aborder les problèmes spécifiques des patients souffrant de polyarthrite. Beaucoup de patients (même s'ils n'en sont pas convaincus au début) disent profiter grandement des réunions que les associations organisent.
Les chiffres de la polyarthrite rhumatoïde
En France, la fréquence de cette maladie est variable selon les études et les critères diagnostiques choisis, mais on estime sa fréquence à 0,4% de la population générale. Elle plus fréquente chez la femme entre 40 et 60 ans, mais elle peut se voir à tous les âges, indépendamment du sexe et de la race. Elle est plus fréquente dans les familles des malades.
Les liens de la polyarthrite rhumatoïde
Le site de la Société Française de Rhumatologie
Le site de l’INSERM
Le site Wikipedia
Les liens internes à Pourquoi Docteur
Le tabac enflamme la polyarthrite rhumatoïde
Polyarthrite rhumatoïde : l’invalidité des patients réduite de moitié en 20 ans
Polyarthrite rhumatoïde : 75 % des patients inactifs à cause de leur pathologie
Polyarthrite : une plante chinoise pour booster l'effet des médicaments
La cortisone et les corticoïdes
Les images de la polyarthrite rhumatoïde libres de droit radio schémas
Les vidéos de la polyarthrite rhumatoïde sur Youtube
AINS
Les anti-inflammatoires non-stéroïdiens, souvent abrégés en « AINS », sont des médicaments aux propriétés anti-inflammatoires, ainsi qu’analgésiques et antipyrétiques, c’est-à-dire qu’ils réduisent l'inflammation, la douleur et la fièvre. Le terme « non-stéroïdien » est utilisé pour les distinguer des glucocorticoïdes, qui (parmi un large éventail d'effets) ont également une action anti-inflammatoire. Les deux AINS les plus connus sont l'aspirine et l'ibuprofène, mais il existe de nombreuses molécules.
Albumine
Principale protéine du sang, l’albumine constitue 50 à 65% des protéines du plasma sanguin (partie liquide du sang). Soluble dans l'eau et fabriquée par le foie, elle ne fait pas partie des globulines qui sont les autres protéines du sang. Son taux, appelé albuminémie est d'environ 40 grammes par litre de sang. L'albumine se trouve également dans l'œuf (ovalbumine) et dans le lait (lactalbumine).
Albuminurie
Le terme protéinurie désigne la présence anormale de protéines, de n'importe quelle nature, dans les urines. L'albuminurie correspond, plus spécifiquement, à la présence anormale dans les urines, d'une variété particulière de protéine : l'albumine.
Anticorps
Les anticorps, appelés également immunoglobulines sont des protéines du sang synthétisées par certaines cellules du système immunitaire (lymphocytes B et plasmocytes) en réponse à l’intrusion d'un corps étranger (antigène) dans l'organisme. Il s'agit plus précisément d'une variété de protéine, les globulines sériques, possédant la propriété particulière de se combiner à une ou plusieurs substances étrangères présentes dans le corps. Les anticorps jouant un rôle essentiel dans la défense de l'organisme sont présents non seulement dans le sang, mais également dans d'autres liquides de l'organisme.
Antigène
L’antigène est une substance étrangère à notre organisme (qu’il ne possède pas habituellement) qui provoque une réaction immunitaire avec un anticorps. L'antigène est neutralisé par l’anticorps spécifique grâce à la présence de sites antigéniques. Ces éléments étrangers, appelés antigènes sont le plus souvent : des bactéries, des virus, des parasites, des champignons, du venin, des vaccins, ou des cellules cancéreuses.
Antipaludéens de synthèse (ou antimalarique)
Les antipaludéens sont des médicaments utilisés dans le traitement curatif ou préventif du paludisme (ou malaria). Ils sont également appelés antimalariques ou antipaludiques. Certains antipaludéens expriment également des propriétés immunomodulatrices qui sont mises à profit dans le traitement des maladies autoimmunes.
Arthrite
Ce nom est donné aux affections inflammatoires aiguës ou chroniques qui touchent les articulations et s’accompagnent d’un gonflement de la membrane synoviale. Quand une seule articulation est atteinte, on parle de monoarthrite. Quand plus de deux articulations sont touchées, il s'agit soit d'oligoarthrite (2 à 4 articulations touchées), puis de polyarthrite (plus de 4 articulations). Le terme d'arthrite ne doit pas être confondu avec celui d'arthralgie qui désigne une douleur, sans gonflement, d'une ou plusieurs articulations.
Arthralgie
L'arthralgie est une douleur située au niveau des articulations sans que l'on ne constate de modification extérieure de la jointure. La douleur augmente quand le patient mobilise la ou les articulations concernées. Les arthralgies sont fréquentes et leur intensité variable selon la maladie en cause. Elles se retrouvent souvent dans les affections articulaires les plus fréquentes comme l’arthrose, mais aussi dans des maladies moins communes comme la polyarthrite rhumatoïde ou la spondylarthrite ankylosante. Le traitement est, bien entendu, directement dépendant de la cause de l'arthralgie.
Athéromatose ou athérosclérose
L’athéromatose est une maladie de la paroi des vaisseaux, en partie provoquée par des anomalies des graisses (hypercholestérolémie, hypertriglycéridémie), mais aussi par l’existence d’une maladie inflammatoire chronique, comme le lupus et la polyarthrite rhumatoïde. Un régime, avec éventuellement un traitement, peut donc normaliser le cholestérol grâce à une alimentation équilibrée, en évitant les « mauvaises graisses » animales (beurre, crème, charcuteries), au profit des « bonnes graisses » végétales (huile d’olive…).
Auto-anticorps
Ce sont des anticorps produits par l’organisme pendant les réactions auto-immunes au cours desquels le patient lutte de façon anormale contre ses propres défenses immunitaires. L’auto-anticorps est donc dirigé contre des parties de son propre organisme.
Auto-immunité
L’auto-immunité reflète l’état pathologique au cours duquel le malade est victime de ses propres défenses immunitaires. Le rôle du système immunitaire est de normalement défendre l'organisme contre les agents extérieurs susceptibles de l'agresser. Le dérèglement de ce système provoque l'apparition d’auto-anticorps et de cellules (lymphocytes cytotoxiques) dirigés contre l'organisme, favorisant ainsi le développement d'une maladie auto-immune.
Biopsie
Une biopsie est un examen médical qui consiste à prélever une portion de tissu d'un organe, afin de pouvoir l'étudier. Son principal intérêt est de donner des résultats objectifs dans des maladies nécessitant un diagnostic certain. Dans le cas des cancers par exemple, l’analyse au microscope des prélèvements effectués permet de voir les cellules cancéreuses, et donc de commencer un traitement que l'on sait justifié. La plupart des biopsies sont indolores après une anesthésie locale voire, notamment chez l'enfant, sous sédation ou anesthésie générale. Certaines biopsies sont profondes et doivent être effectuées sous contrôle échographique ou scannographique.
Biothérapie
Les biothérapies désignent une nouvelle génération de médicaments. Sur le modèle de molécules biologiques naturelles, elles sont similaires ou identiques à des protéines produites par l’organisme (enzymes, protéines, anticorps). Dans les maladies auto-immunes, notre corps produit une quantité excessive d’auto-anticorps. Les biothérapies sont des substances capables de bloquer l’action de ces auto-anticorps. Une fois administrées, elles atteignent spécifiquement leur cible, une protéine, pour la bloquer ou l’éliminer.
Céphalées
Les céphalées sont des douleurs de la tête, quelle que soit leur cause. Couramment appelées « maux de tête », elles siègent sur la voûte crânienne, en excluant le cou et la face. Très fréquentes, elles constituent l'un des premiers motifs de consultation médicale. Leur diagnostic n'est pas toujours aisé. On s'aide parfois d'examens sanguins, ophtalmologiques ou dentaires, de radiographies des sinus ou de l'ensemble du crâne, exceptionnellement d'un électroencéphalogramme ou d'un scanner cérébral. L'évolution des céphalées est très variable, de quelques heures à quelques jours, les accès pouvant se répéter pendant plusieurs années.
Cyclophosphamide
Médicament de la famille des immunosuppresseurs (cf. immunosuppresseur)
Cytokine
Les cytokines sont des petites protéines qui agissent sur des cellules de types variés possédant des récepteurs propres pour chacune d’entre elles. Sécrétées par les lymphocytes (globules blancs intervenant dans l’immunité cellulaire) et les macrophages (cellules de défenses chargées de digérer les particules étrangères), elles sont impliquées dans le développement et la régulation des réponses immunitaires. Certaines cytokines ont reçu le nom de leur fonction principale (interférons, TNF ou « facteur nécrosant les tumeurs ») ; d’autres portent le nom d’interleukine, suivi d’un numéro (de 1 à 13).
Cytopénie
La cytopénie est un terme définissant d’une manière générale la diminution progressive des lignées cellulaires.
Cytotoxique
Une substance se dit cytotoxique quand elle est nocive pour les cellules, et donc quand elle a la propriété de les altérer ou de les détruire (exemple : un médicament cytotoxique).
Dyslipémie (dyslipidémie)
La dyslipémie est une anomalie qui touche les graisses présentes dans le sang ; il s’agit souvent d’un excès du taux du cholestérol et des triglycérides. Pour certains, dyslipémie et dyslipidémie sont synonymes. Ces facteurs sont utiles à dépister pour les corriger.
Échographie
L’échographie est une méthode d’examen qui emploie les ultrasons et permet de visualiser certaines parties de l'organisme habituellement cachées à la vue. Elle est essentiellement utilisée en obstétrique (imagerie du fœtus), mais également pour effectuer une ponction ou une biopsie, pour visualiser certaines glandes (thyroïde) et la plupart des organes. Les ultrasons, qui ont la capacité de se propager dans les milieux liquides, ne sont arrêtés que par l'air et par les os. Les organes pleins, comme les reins ou le foie, sont particulièrement bien étudiés grâce à l'échographie.
Éducation thérapeutique (médicale)
Selon la définition de l'OMS, l'éducation thérapeutique du patient est un processus continu, intégré dans les soins et centré sur le patient. Elle comprend des activités organisées de sensibilisation, d'information, d'apprentissage et d'accompagnement psychosocial concernant la maladie, le traitement prescrit, les soins, l'hospitalisation et les autres institutions de soins concernées, et les comportements de santé et de maladies du patient. Elle vise à aider le patient et ses proches à comprendre la maladie et le traitement, coopérer avec les soignants, vivre le plus sainement possible et maintenir ou améliorer la qualité de vie.
Électrocardiogramme
L'électrocardiogramme enregistre le fonctionnement électrique du cœur au cours de son cycle relaxation-contraction. Le cœur étant un muscle, il a besoin d’une stimulation électrique pour se contracter. Ces influx électriques se propagent à partir du nœud de stimulation de l’oreillette à l’ensemble du muscle cardiaque et sont en quelque sorte le reflet du fonctionnement électrique du cœur.
Enzyme
Une enzyme est un catalyseur biologique, c’est-à-dire une molécule permettant d'accélérer jusqu'à des millions de fois les réactions chimiques du métabolisme se déroulant dans le milieu cellulaire ou extracellulaire. Les enzymes agissent à faible concentration et elles se retrouvent intactes en fin de réaction.
Facteur d’environnement
Les facteurs d’environnement sont les éléments ou événements extérieurs qui ont une influence sur la déclaration d’une maladie.
Hémogramme
L'hémogramme est le résultat de l'étude quantitative et qualitative des éléments figurés du sang, c’est-à-dire les globules rouges, les globules blancs et les plaquettes.
Hémolyse
L’hémolyse est la destruction normale ou pathologique des hématies (globules rouges). Cette destruction est le fait de processus multiples, dont les hémolyses auto-immunes. Un globule rouge vit en moyenne environ une centaine de jours. Une fois l’hématie détruite, l’hémoglobine est libérée et, si ce n’est pas en trop grandes quantité, elle entre dans un processus de recyclage et de fabrication d’un nouveau globule rouge.
Hormone
Les hormones sont des messagers chimiques qui régulent certains systèmes du corps. Par exemple, l'insuline est l'hormone qui permet de réguler le taux de sucre dans le sang, c'est-à-dire la quantité de glucide à l'intérieur de la circulation sanguine.
Hypergammaglobulinémie
L’hypergammaglobulinémie est l’augmentation de la concentration sérique des gammaglobulines au-dessus de 18 g/l. Cette augmentation se rencontre au cours de divers syndromes inflammatoires ou lors de proliférations plasmocytaires malignes.
Hyperglycémie
L'hyperglycémie est l’augmentation de la quantité de glucose (sucre de façon générale) au-dessus de 1,2 g/l, contenue dans le sang. Le glucose est la principale substance énergétique, mais son excès peut aboutir à des complications.
Immunogénétique
L’immunogénétique est l’étude des facteurs génétiques qui interviennent dans les mécanismes de l'immunité.
Immunosuppresseur
Le terme immunosuppresseur (ou immunodépresseur) désigne tout ce qui supprime ou qui a la capacité de réduire les réactions immunologiques spécifiques de l'organisme contre un antigène (corps étranger pénétrant dans l'organisme).
IRM (Imagerie par Résonance Magnétique)
L’IRM utilise l’énergie magnétique des protons pour étudier avec une grande précision de nombreux organes comme le cerveau, la colonne vertébrale, les articulations et les tissus mous. Elle est d’une grande utilité lorsqu’une analyse très fine est nécessaire et que certaines lésions ne sont pas visibles sur les radiographies standard, l’échographie ou le scanner. Elle permet de faire des images en coupes dans différents plans et de reconstruire en trois dimensions la structure analysée.
Lymphocyte
Variété de globules blancs, les lymphocytes interviennent dans la réponse immunitaire. Ils sont de deux sortes : les lymphocytes B (production d'anticorps) et les lymphocytes T (immunité à médiation cellulaire). Ce sont des petites cellules mobiles se trouvant dans le sang, la moelle osseuse et les tissus lymphoïdes (rate, ganglions lymphatiques) qui jouent un rôle central dans le système immunitaire. Il y a plusieurs familles de lymphocytes, dont une est responsable de la synthèse des anticorps, mais toutes font partie de celle des leucocytes (globules blancs).
Lymphopénie
Le terme lymphopénie désigne la diminution du nombre des lymphocytes.
Macrophage
Le macrophage est une variété de globule blanc, de grande taille, ayant la propriété d'absorber et de détruire de grosses particules comme une cellule abîmée ou âgée, mais aussi des éléments étrangers (bactéries, virus, champignons, etc.) par un procédé appelé phagocytose.
Myalgies
Les myalgies sont des douleurs musculaires. On les rencontre dans diverses maladies, aiguës ou chroniques, d'origine mécanique, inflammatoire, chimique, infectieuse ou auto-immune. Le traitement est celui de la maladie responsable. En outre, pour soulager la douleur, il est fait appel aux analgésiques locaux ou généraux et aux décontracturants.
Myélogramme
Le myélogramme est une étude de la moelle que l’on prélève sous anesthésie locale. Il consiste à analyser la morphologie et l'équilibre des différentes cellules présentes dans la moelle osseuse dont le rôle est la production des cellules sanguines (globules rouges, blancs et plaquettes).
Neutropénie
La neutropénie est un trouble sanguin qui survient lorsque le nombre de polynucléaires neutrophiles, un des types de globules blancs présents dans le sang est anormalement faible. Les neutrophiles participent à la lutte contre les agents infectieux dans l’organisme. Les personnes qui en comptent trop peu sont donc plus vulnérables aux infections d’origine bactérienne et à certains types d’infections d’origine fongique. Ces infections peuvent devenir graves, voire mortelle.
Neutrophile
Les neutrophiles sont les polynucléaires neutrophiles, une catégorie de globules blancs capables de combattre les infections bactériennes.
Placebo
L’effet placebo est l’effet qui peut être observé en prenant un traitement qui ne contient aucun principe actif. Cet effet placebo, que l’on attribue en partie à la sensation de mieux-être que représente le fait de prendre un médicament, peut être parfois relativement spectaculaire, avec des améliorations de l’ordre de 30 %. En général, cet effet s’amenuise en quelques semaines. C’est pour cette raison que les nouveaux médicaments doivent être comparés à une molécule sans principe actif dénommé placebo.
Plaquette
Une plaquette (ou thrombocyte) est un élément figuré du sang qui est formé dans la moelle osseuse et se fragmente en petits éléments. Les plaquettes ne sont donc pas des cellules complètes, mais uniquement de petits fragments dépourvus de noyau. Leur durée de vie est d'environ 8 à 10 jours et leur lieu de dégradation est la rate. Elles sont un des composants indispensables à la coagulation du sang (ou hémostase).
Pleurésie
La pleurésie est l'inflammation de la membrane qui recouvre et protège les poumons, la plèvre. Cette inflammation peut survenir, soit de façon aiguë (relativement rapidement), soit de façon chronique (s'étalant sur une longue période). La pleurésie s'accompagne, ou pas, de présence de liquide entre les deux feuillets de la plèvre (épanchement).
Polyarthrite rhumatoïde
La polyarthrite rhumatoïde est une maladie inflammatoire du tissu conjonctif qui touche de préférence la synoviale qui entoure les articulations. La polyarthrite rhumatoïde est le plus fréquent des rhumatismes inflammatoires chroniques. Elle est caractérisée par son évolution par poussées successives, sa localisation préférentielle aux membres, sa tendance destructrice, ankylosante et déformante. C'est aussi une maladie systémique appartenant au groupe des connectivites comportant des manifestations extra-articulaires.
Polynucléaire
Le polynucléaire est une cellule essentielle de notre organisme car il est chargé de l'élimination des agents pathogènes, comme les bactéries, après leur reconnaissance par le système immunitaire.
Rémission
La rémission est la forte atténuation, ou la disparition temporaire des symptômes d'une maladie.
Rétinopathie
Une rétinopathie concerne toutes les affections de la rétine, quelle que soit sa cause. La plupart du temps, il n'y a pas de symptôme perceptible par le malade. Parfois, un saignement dans le corps vitré entraîne l'apparition de mouches volantes dans le champ visuel.
Thrombopénie
La thrombopénie est la diminution du nombre de plaquettes au-dessous de 150 000 par mm3 dans le sang circulant. Composantes du sang, les plaquettes sont des petits sacs de dimensions plus importantes que des cellules, contenant des substances chimiques actives permettant le processus de la coagulation. Le contraire de la thrombopénie est la thrombocytose ou hyperplaquettose (nombre trop élevé de plaquettes dans le sang).
Thrombose
La thrombose veineuse est la formation d'un caillot de sang dans une veine. Elle survient généralement dans une veine des membres inférieurs, au niveau de la jambe ou de la hanche, rarement au niveau des membres supérieurs. La thrombose veineuse peut être superficielle lorsqu'elle touche une veine proche de la surface de la peau ou profonde lorsqu'elle est localisée à l'intérieur d'un muscle. Le plus souvent, la thrombose veineuse s'accompagne d'une phlébite, réaction inflammatoire de la veine lorsque le caillot grossit et adhère à la paroi. En pratique, on appelle généralement « phlébite » une thrombose veineuse profonde. L'évolution de la thrombose veineuse profonde peut être grave, voire fatale si le caillot se détache, circule dans le sang et vient boucher une artère au niveau du poumon provoquant une embolie pulmonaire.



















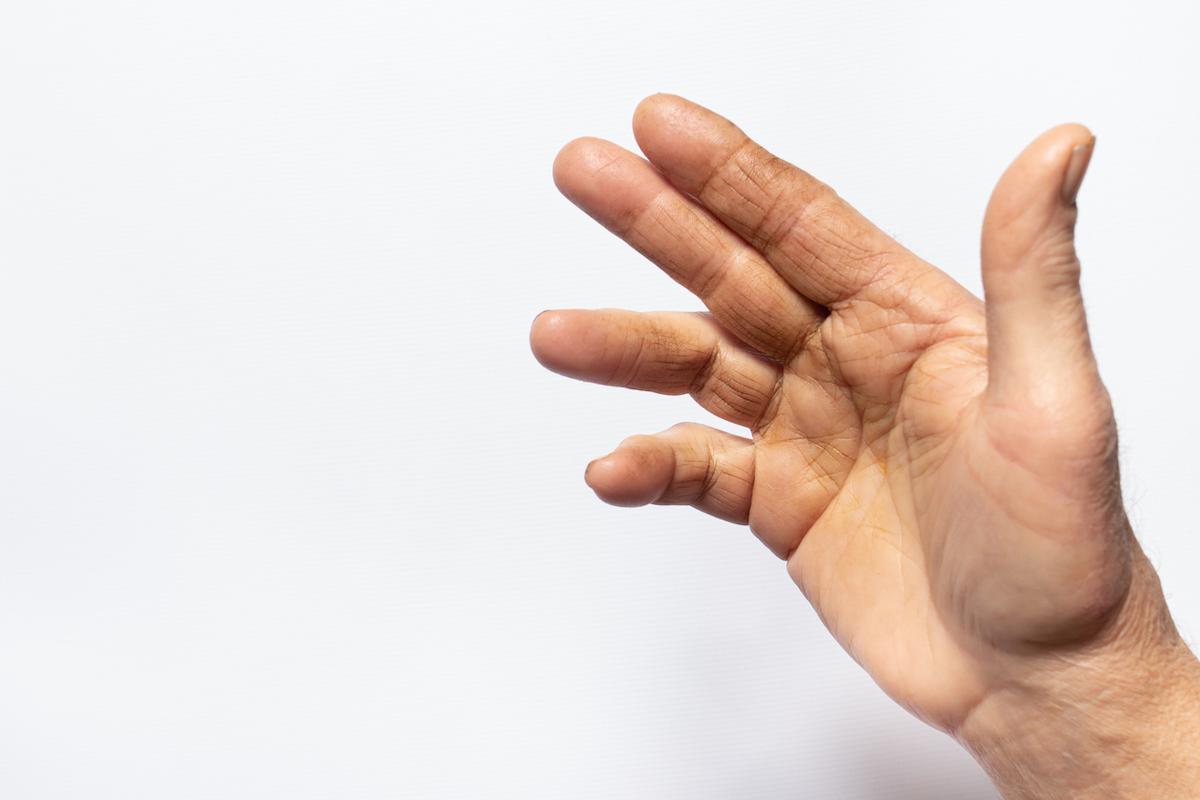



Commentaires
Ajouter un commentaire
commentaires