Rhumatologie
Maladie de Horton : un anti-JAK efficace à forte dose pour accélérer le sevrage en corticoïdes
Dans l'artérite à cellules géantes, l'upadacitinib à la dose de 15 mg par jour permet de raccourcir la corticothérapie à 6 mois tout en améliorant significativement le taux de rémission soutenue.

- Tero Vesalainen/istock
L’artérite à cellules géantes, ou maladie de Horton, est la vascularite la plus fréquente chez les adultes de plus de 50 ans. Actuellement, les corticoïdes constituent la principale option thérapeutique, malgré leurs effets secondaires significatifs et les fréquentes rechutes lors du sevrage. Seuls les inhibiteurs du récepteur de l’IL6 permettent de réduire cette corticothérapie. L’upadacitinib est un inhibiteur de JAK qui bloque la signalisation de plusieurs interleukines, dont IL6 et interféron gamma.
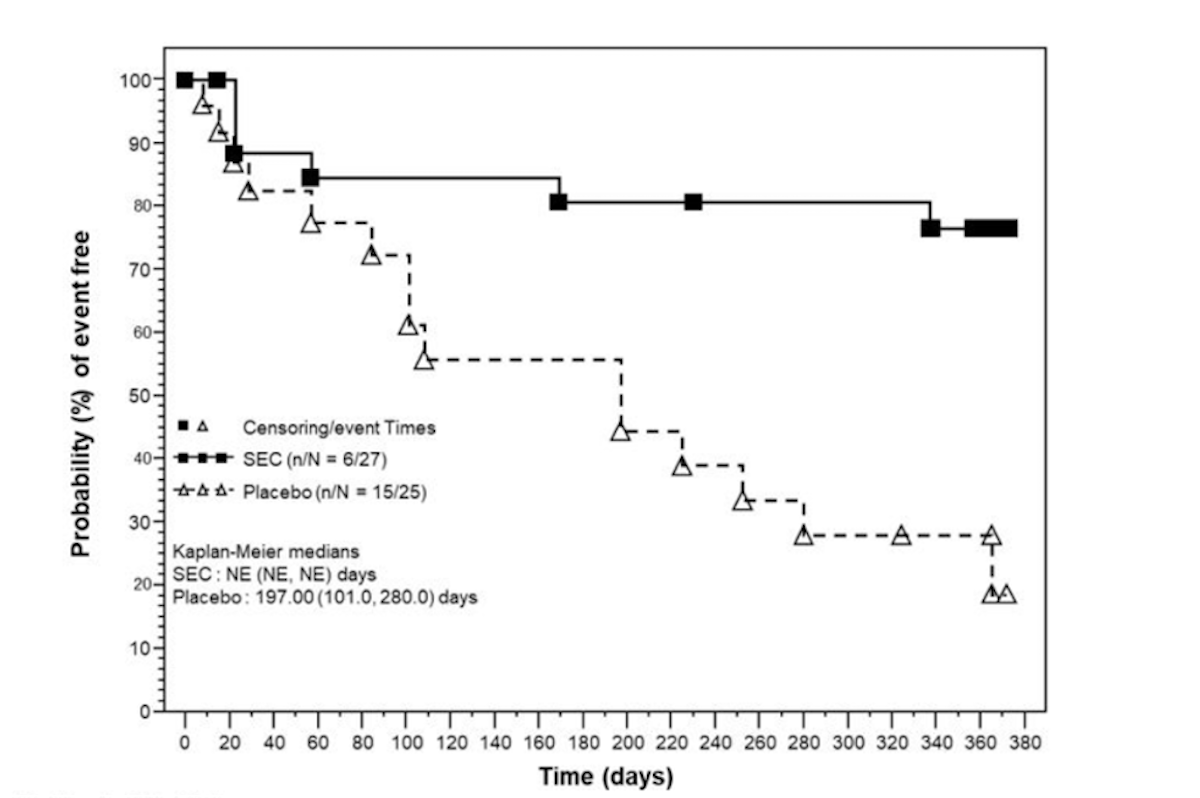
L’étude SELECT-GCA a évalué l’efficacité de l’upadacitinib, un inhibiteur oral sélectif de Janus kinase 1 (JAK-1), à 2 doses (7,5 et 15 mg/jour) et par comparaison au placebo, en association avec un sevrage corticoïde raccourci. L’essai révèle que l’upadacitinib à la dose de 15 mg par jour entraîne une rémission soutenue à 52 semaines chez 46,4 % des patients contre 29 % dans le groupe placebo (p=0,002). Cette meilleure efficacité permet une diminution significative de la corticothérapie cumulée (1615 mg vs 2882 mg ; p<0 .001) et améliore la qualité de vie des patients. L’étude est publiée dans le New England Journal of Medicine.
Une amélioration significative du taux de rémission
Concernant les résultats secondaires, l’upadacitinib 15 mg par jour s’est avéré également supérieur au placebo sur la rémission complète soutenue, avec davantage de patients atteignant une rémission complète sans corticoïdes à 52 semaines. Le délai jusqu’à une rechute est significativement prolongé avec la dose de 15 mg par rapport au placebo. Le traitement permet également une réduction notable de la fatigue et une amélioration significative des indicateurs rapportés par les patients.
La tolérance globale est comparable entre les groupes traités par upadacitinib et placebo, sans augmentation majeure des effets indésirables graves. Toutefois, un risque accru de zona et d'élévation de la créatine kinase est observé avec la dose de 15 mg, ce qui concorde avec les profils d’effets secondaires connus des inhibiteurs de JAK. Aucun événement cardiovasculaire majeur n’a été enregistré dans les groupes sous upadacitinib, tandis que deux incidents cardiovasculaires graves sont survenus sous placebo.
Une étude multicentrique randomisée en double aveugle sur 428 patients
Cette étude multicentrique internationale randomisée en double aveugle incluant 428 patients recrutés dans 24 pays garantit une bonne représentativité des résultats. Le critère principal de rémission soutenue, indépendant des marqueurs inflammatoires biologiques, renforce la robustesse des conclusions. Cependant, l’étude présente quelques limitations, notamment un taux d’abandon plus élevé que prévu, probablement dû à la pandémie de Covid-19 et à la disponibilité du tocilizumab, anti-IL6r déjà approuvé. La durée relativement courte de l’étude limite les conclusions sur la sécurité à long terme, en particulier concernant le risque cardiovasculaire potentiellement accru dans cette population âgée.
Des recherches complémentaires sont nécessaires pour évaluer l’efficacité chez les patients réfractaires aux inhibiteurs de l’interleukine-6. Selon les auteurs, ces résultats avec un immunomodulateur au profil plus large que les anti-IL6r encouragent l’utilisation d’upadacitinib comme une alternative efficace pour réduire la dépendance aux corticoïdes dans la maladie de Horton. Le profil de sécurité est acceptable si l'on se rappelle qu'il faut vacciner contre le zona et le pneumocoque ces patients avant de mettre en route l'upadacitinib. La poursuite des études sur le long terme demeure essentielle pour valider ces bénéfices et préciser les éventuels risques associés.