Avec des restrictions d'utilisation
L'Europe maintient sur le marché le Protelos
L'Agence européenne du médicament recommande le maintien de ce médicament sur le marché alors que l'un de ses comités scientifiques, le Prac, préconisait sa suspension.

Rebondissement dans l'affaire du Protelos, ce médicament des laboratoires Servier presrit dans l'ostéoporose. L'Agence européenne du médicament (EMA) vient de recommander le maintien de ce produit sur le marché, avec des restrictions d'utilisation. Une décision qui peut surprendre, car, le mois dernier, le Comité pour l'évaluation des risques en matière de pharmacovigilance, le Prac, une instance européenne, recommandait sa suspension.
Ce médicament entraîne en effet des risques d'infarctus du myocarde, d'accidents thromboemboliques veineux et de réactions cutanées allergiques graves.
Mais l'EMA considère que les risques peuvent être limités en restreignant l'utilisation du ranélate de strontium (Protelos) aux patients atteints d'ostéoporose sévère, sans antécédents de pathologies cardiovasculaires et circulatoires, et qui ne peuvent utiliser d'autres alternatives thérapeutiques.
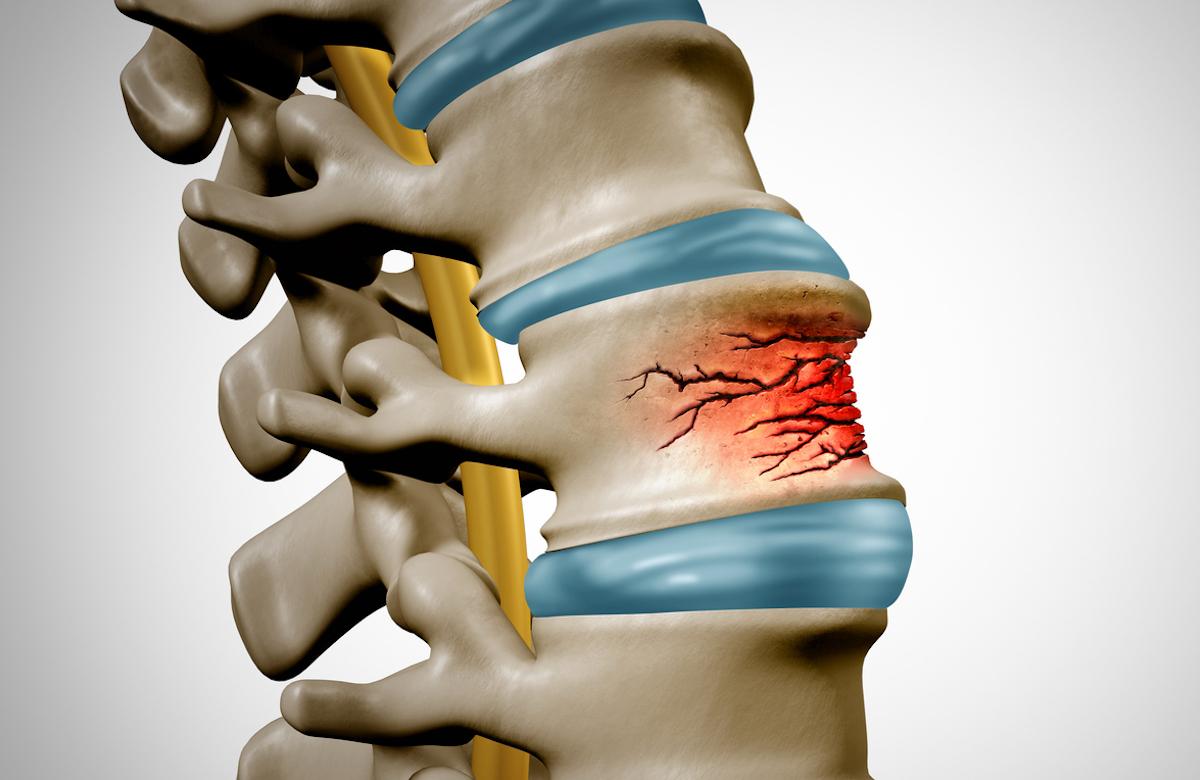
En France, ce produit est commercialisé depuis 2006, et fait l'objet d'une surveillance renforcée. Il est utilisé chez la femme ménopausée ou chez l'homme atteint d'ostéoporose, afin de réduire le risque de fractures osseuses. Au total, 400 000 personnes ont été traitées par ce médicament.
En 2012, les autorités de santé européennes avaient considéré le rapport bénéfice-risque favorable sous réserve de nouvelles contre-indications. Puis en 2013, elles avaient contre-indiqué Protelos chez les patients à risque cardiovasculaire.
Une décision finale de la Commission européenne devrait être rendue d'ici deux mois. En attendant, l'Agence française du médicament recommande aux patients qui prennent actuellement ce traitement de consulter leur médecin traitant.