Hématologie
Purpura thrombopénique auto-immun : un anticorps anti-CD38 change le pronostic
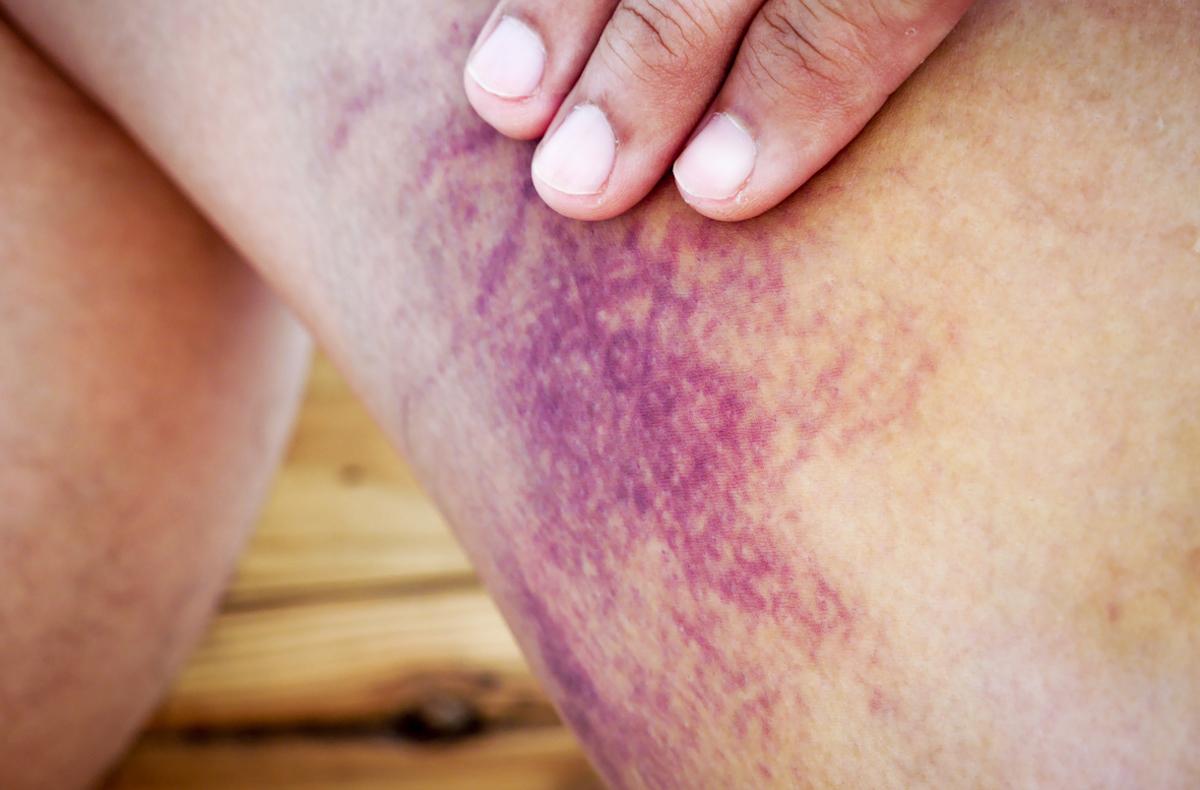
Le purpura thrombopénique auto-immun (PTI) est une maladie auto-immune sévère caractérisée par une thrombopénie immuno-médiée par des auto-anticorps et un risque élevé de saignements. Les traitements actuels, très variés, donnent des réponses hétérogènes. Une étude explore l'efficacité d’un nouvel anticorps monoclonal anti-CD38, offrant des perspectives prometteuses pour cette pathologie.
- praisaeng/istock
Le purpura thrombopénique auto-immun (PTI) est une maladie auto-immune hématologique caractérisée par une diminution du nombre de plaquettes en dessous de 100×109 par litre, augmentant ainsi le risque de saignement. Elle touche annuellement environ 2 à 4 adultes pour 100 000 habitants. Les patients atteints de PTI ont souvent un risque plus élevé d'hospitalisations, une tendance à la fatigue et une qualité de vie liée à la santé compromise. Les manifestations cliniques incluent principalement des saignements cutanés et muqueux, dont la gravité dépend du taux de plaquettes. Les épisodes hémorragiques les plus graves ont été documentés chez les adultes avec des taux de plaquettes inférieurs à 30×109 par litre.
Les corticoïdes sont le traitement de première ligne du PTI, avec une réponse initiale chez la majorité des patients. Cependant, seulement 20 à 40% des patients maintiennent une réponse plaquettaire après l'arrêt du traitement, les effets secondaires à long terme des corticoïdes rendant leur usage prolongé non recommandé. Les patients réfractaires ou en rechute après le traitement de première ligne sont généralement par avec le rituximab, les agonistes des récepteurs de la thrombopoïétine ou par splénectomie. Malgré cette diversité thérapeutique, les réponses des patients restent hétérogènes tant en termes de magnitude que de durée des effets.
Une nouvelle voie thérapeutique émerge avec les anticorps monoclonaux anti-CD38.
CM313, un anticorps monoclonal humanisé anti-CD38, a montré des résultats prometteurs en phase préclinique, avec une destruction efficace des cellules tumorales et un profil d'effets secondaires favorable.
Une étude de phase 1-2, en ouvert, a été menée pour évaluer la sécurité et l'efficacité du CM313 chez les patients adultes atteints de PTI. CM313 a été administré par voie intraveineuse à une dose de 16 mg/kg par semaine pendant 8 semaines, suivies d'une période de suivi de 16 semaines. Les principaux résultats mesurés étaient les événements indésirables et l'obtention de deux comptages plaquettaires consécutifs d'au moins 50×109 par litre dans les 8 semaines suivant la première dose.
Des résultats prometteurs
Sur les 22 patients inclus, 21 (95 %) ont atteint deux comptages plaquettaires consécutifs d'au moins 50×109 par litre pendant la période de traitement, avec une durée médiane de réponse cumulative de 23 semaines. Le temps médian pour atteindre le premier comptage de plaquettes d'au moins 50×109 par litre était d'une semaine.
Les événements indésirables les plus fréquents étaient les réactions liées à l'infusion et les infections des voies respiratoires supérieures, chacune survenue chez 32 % des patients.
Cette étude démontre que la thérapie ciblée anti-CD38 augmente rapidement les taux de plaquettes en inhibant la cytotoxicité cellulaire dépendante des anticorps et maintient une efficacité à long terme en éliminant les plasmocytes, avec des effets toxiques principalement de faible gravité.
PTI : une physiopathologie complexe
La physiopathologie du PTI est complexe et implique généralement une perte de tolérance immunitaire envers les auto-antigènes plaquettaires, menant à la production d'auto-anticorps antiplaquettaires. Cela entraîne une destruction des plaquettes médiée par les anticorps et une production insuffisante de plaquettes par les mégacaryocytes. Les cellules T CD8+ jouent un rôle crucial dans cette pathogénie, notamment via des clones spécifiques induisant l'activation et l'apoptose plaquettaires indépendamment des anticorps.
Des études ont révélé la présence de plasmocytes spécifiques des plaquettes dans la rate des patients traités par rituximab, expliquant la résistance à ce traitement. Ces cellules peuvent également migrer vers la moelle osseuse et y résider en tant que plasmocytes de longue durée de vie, participant activement aux réponses immunitaires. Ainsi, les stratégies ciblant uniquement les cellules B, telles que le rituximab et la splénectomie, peuvent être inefficaces en raison de la production persistante d'anticorps par ces plasmocytes de longue durée.
Ces résultats ouvrent la voie à de nouvelles stratégies thérapeutiques prometteuses pour les patients atteints de purpura thrombopénique auto-immun.