Rhumatologie
Horton et PPR : maux de tête, douleurs des épaules et des hanches le matin après 50 ans
La maladie de Horton et la pseudo-polyarthrite rhizomélique (PPR) sont 2 vascularites souvent associées après 50 ans et qui partagent plusieurs caractéristiques pathogéniques. L’enjeu est lié aux complications artérielles ophtalmiques et aortiques en l’absence de traitement efficace dans le Horton, qui peut-être une complication de la PPR. Le traitement corticoïde devrait désormais pouvoir être raccourci grâce aux biothérapies, anti-IL6 en particulier.
- Zay Nyi Nyi/istock
La maladie de Horton (ou artérite à cellules géantes) et la pseudo-polyarthrite rhizomélique (PPR) sont des maladies inflammatoires touchant principalement les personnes âgées de plus de 50 ans. Ces deux affections partagent plusieurs caractéristiques pathogéniques et facteurs de risque, et peuvent se déclarer simultanément ou indpendamment ou la maladie de Horton peut suivre la PPR.
La maladie de Horton est une vasculopathie inflammatoire qui survient typiquement dans les artères de gros et moyen calibre, avec des couches de paroi bien développées et des vasa vasorum adventitiels. Les lits vasculaires les plus souvent affectés incluent les branches carotidiennes externes (par exemple, les artères temporales et occipitales), les artères ophtalmiques, vertébrales, sous-clavières distales, et axillaires, ainsi que l'aorte thoracique.
L'aorte et ses principales branches seraient touchées chez un quart des patients souffrant d'artérite à cellules géantes. La maladie des gros vaisseaux est diagnostiquée de manière fiable avec la tomodensitométrie ou l'imagerie par résonance magnétique. La vascularite des artères moyennes entraîne une occlusion luminale et donc des complications ischémiques, telles que la neuropathie optique ischémique, qui provoque une perte de vision chez 10 à 15% des patients. L'aortite peut être compliquée par une dissection et la formation d'anévrismes.
La pseudo-polyarthrite rhizomélique cause des douleurs et des raideurs dans les groupes musculaires des ceintures, principalement au niveau du cou, des épaules, des bras et de la ceinture pelvienne, mais le tableau est parfois plus atypique. Les symptômes sont plus prononcés le matin et ont un caractère inflammatoire net. La source des myalgies n’est pas très bien définie. Les études d'imagerie ont révélé une inflammation des bourses et des structures périarticulaires. De plus, les fluides interstitiels des muscles douloureux contiennent des niveaux élevés de cytokines. Typiquement, ces myalgies sont associées à une inflammation systémique marquée, avec des niveaux élevés de la VS et de la CRP.
Épidémiologie et facteurs de Risque
Le Horton et la PPR affectent principalement les personnes âgées, avec des pics d'incidence entre 70 et 80 ans. L'âge de 50 ans ou plus est considéré comme un critère de diagnostic. Les femmes représentent 65 à 75% des patients. La PPR survient à une fréquence de 3 à 10 fois supérieure à celle de la maladie de Horton. Le risque de maladie varie selon la race et la région géographique, mais l’incidence est plus élevée chez les populations blanches du nord de l'Europe (environ 20 cas pour 100 000 personnes de plus de 50 ans), plus faible dans les populations du sud de l'Europe (environ 10 cas pour 100 000) et nettement plus faible chez les populations américaines d'origine asiatique ou africaine (environ 1 cas pour 100 000).
Les polymorphismes HLA modulent le risque de maladie. Un début tardif de la maladie suggère que des expositions environnementales influencent les facteurs de susceptibilité ; le statut socio-économique n'a pas d'effet notable.
Une vascularite concernant les voies IL-12 et IL-6
Les études moléculaires de la vascularite des gros vaisseaux suggèrent que les cellules dendritiques résidant dans la paroi des vaisseaux initient la cascade pathogène et recrutent des lymphocytes T et des macrophages pour former des infiltrats granulomateux.
Les lésions vasculaires des artères temporales enflammées contiennent des cytokines correspondant à 2 grands réseaux de réponse immunitaire : l'axe interleukine-12-cellule T auxiliaire de type 1 (Th1)-interféron-γ et l'axe interleukine-6-cellule T auxiliaire de type 17 (Th17)-interleukine-17 ou interleukin-21 ; ce dernier (mais pas le premier) est efficacement supprimé par un traitement avec des corticoïdes.
Les cytokines effectrices libérées dans la paroi artérielle activent les cellules inflammatoires et ciblent les cellules endothéliales, les cellules musculaires lisses vasculaires et les fibroblastes, ce qui entraîne une hyperplasie intimale obstruant la lumière. Les enzymes élastolytiques et protéolytiques et les facteurs proangiogéniques et de croissance favorisent le remodelage de la paroi artérielle, d'où les résultats caractéristiques de l'imagerie et les manifestations cliniques.
Intérêt de l'imagerie et de la biopsie d’artère temporale
Une vascularite des gros vaisseaux survient donc chez 25% des patients souffrant d'artérite à cellules géantes et les recommandations d’imagerie sont donc toutes concordantes. Une imagerie des gros vaisseaux est recommandée au diagnostic de maladie de Horton, à la recherche d’une aortite et/ou d’une atteinte des gros vaisseaux, car le pronostic de ces patients est moins bon.
L'angiographie par résonance magnétique (angio-IRM) ou l'angiographie tomodensitométrique (angio-scanner) de la crosse aortique et de ses principales branches est utile chez les patients dont l'artérite à cellules géantes a été confirmée par biopsie, afin d'évaluer l'étendue de l'atteinte artérielle (y compris la présence de sténoses, de dissections et d'anévrismes) et de surveiller les lésions vasculaires pour déceler tout signe d'évolution. L'angio-IRM ou l'angio-scanner peuvent également être utilisés pour identifier l'atteinte des gros vaisseaux chez les patients souffrant d'une suspicion d'artérite à cellules géantes qui n'a pas été confirmée par la biopsie et chez lesquels il existe des signes cliniques de maladie ischémique périphérique.
L'utilisation du 18F-fluorodéoxyglucose(18F-FDG) avec tomographie par émission de positons et tomodensitométrie (TEP-scan), qui détecte les cellules hypermétaboliques, a été proposée pour quantifier la charge inflammatoire de l’atteinte des gros vaisseaux.
L'échographie Doppler couleur peut être utilisée pour visualiser les artères superficielles, comme l'artère temporale, mais son utilité pour évaluer les parois des vaisseaux plus profonds est limitée. L'œdème de la paroi des vaisseaux superficiels produit un signal hypoéchogène à l'échographie Doppler couleur, appelé « signe du halo ». L'IRM à haut champ pourrait devenir une méthode sensible à la détection de l'inflammation de l'artère temporale, mais ni l'échographie ni l'IRM n'ont encore remplacé la biopsie de l'artère temporale, qui est très sensible aux changements inflammatoires, même mineurs.
Dans la pseudo-polyathrite rhizomélique, l'échographie ou l'IRM peut identifier une bursite sous-acromiale, sous-deltoïdienne, trochantérienne et cervicale, ainsi qu'une ténosynovite de la tête du long biceps. La synovite articulaire périphérique doit faire suspecter un autre diagnostic, comme la polyarthrite rhumatoïde ou l'arthrose inflammatoire. Les critères de classification actuels n'exigent pas l'utilisation de l'échographie pour établir le diagnostic de pseudo-polyarthrite rhizomélique.
En cas de suspicion d'artérite à cellules géantes, la vérification histologique de la vascularite doit être recherchée systématiquement, selon les recommandation américaines, par une biopsie de l'artère temporale avec évaluation d'un segment vasculaire de 1,5 à 2,0 cm de long. Cette biopsie sera, au mieux, dirigée en fonction de l’écho-doppler. L'analyse histologique permet de détecter de petits infiltrats inflammatoires et de distinguer l'artérite à cellules géantes des artérites non à cellules géantes (comme la vascularite à ANCA). Une biopsie négative n'exclut pas une artérite à cellules géantes mais la biopsie précoce identifie 85 à 95% des cas d'artérite. Les artères temporales ne sont souvent pas concernées chez les patients souffrant d'artérite à cellules géantes qui ont une atteinte sous-clavière prédominante. Les biopsies bilatérales de routine sont déconseillées.
En cas de forte suspicion de maladie de Horton, l’EULAR suggère par contre qu’une imagerie des artères temporales, en particulier un écho-doppler des artères temporales à la recherche d’un signe du halo, suffit pour confirmer le diagnostic de maladie de Horton et qu’il n’est donc plus nécessaire de réaliser de biopsie d’artère temporale (BAT) dans cette situation. A l’inverse, si la suspicion diagnostique est faible, la normalité de l’imagerie des artères temporales permet d’exclure le diagnostic.
La neuropathie optique artéritique est une véritable urgence et le traitement ne doit pas être retardé par la biopsie d’artère temporale en raison du risque de perte de vision. La sensibilité diagnostique de la biopsie de l'artère temporale reste élevée même après que le traitement par corticoïdes a été instauré ; la sensibilité diminue après plusieurs semaines de traitement.
Critères diagnostiques
Le diagnostic d'artérite à cellules géantes est envisagé sur la base des antécédents médicaux, de l'évaluation clinique et des examens de laboratoire et d'imagerie, et il est confirmé sur la base des résultats histologiques lors de la biopsie d’artère temporale au mieux dirigée par l’échographie de l’artère temporale. La maladie de Horton s’accompagne de plusieurs signes cliniques caractéristiques. Les patients souffrent souvent de céphalées temporales, des douleurs de tête localisées au niveau des tempes, qui sont généralement sévères et persistantes. Ils peuvent également ressentir une sensibilité du cuir chevelu, notamment au toucher des tempes. La claudication de la mâchoire est un autre symptôme fréquent, se manifestant par une douleur et une fatigue des muscles de la mâchoire lors de la mastication ou de la parole prolongée. Les troubles visuels sont particulièrement préoccupants, incluant une vision floue, une double vision ou même une perte de vision soudaine, signes possibles d’une ischémie de l'artère ophtalmique. Les symptômes systémiques tels que la fièvre, la perte de poids, la fatigue et un malaise général sont courants.
L'absence de caractéristiques cliniques et de laboratoire pathognomoniques rend la pseudo-polyarthrite rhizomélique plus difficile à diagnostiquer, à moins qu'elle ne s'accompagne d'une artérite à cellules géantes.
Le diagnostic du Horton repose sur la combinaison de signes cliniques, de résultats de laboratoire, et de résultats d'imagerie, confirmés par des résultats histologiques. Les signes biologiques consistent en une élévation marquée de la VS et de la CRP, une thrombocytose, et une anémie inflammatoire (Sensibilité d'une VS élevée : 84 % ; Sensibilité d'un taux élevé de CRP : 86 %). L’électrophorèse des protéines sériques est demandée pour détecter une gammapathie monoclonale, qui est un diagnostic différentiel. Les auto-anticorps sont demandés pour exclure d'autres maladies rhumatismales, en particulier en cas d’arthrite vraie associée, même si celle-ci peut se voir au cours de la PPR. La biopsie de l'artère temporale reste l’examen standard pour le diagnostic du Horton, et elle est capable de détecter des infiltrats inflammatoires même mineurs. Pour mémoire, une biopsie négative n'exclut pas un Horton.
Un traitement basé sur la corticothérapie dont on cherche à réduire la durée
Contrairement à certaines croyances selon lesquelles l'artérite à cellules géantes et la pseudo-polyarthrite rhizomélique sont des pathologies inflammatoires spontanément résolutives, la vascularite persiste chez de nombreux patients, avec un risque de complications si elle n’est pas traitée.
La plupart des recommandations thérapeutiques sont basées sur l'expérience clinique plutôt que sur les résultats d'essais randomisés et contrôlés, sauf pour les biothérapies. L'artérite à cellules géantes et la pseudo-polyarthrite rhizomélique répondent aux corticoïdes qui sont donc le traitement de première intention et la plupart des cas réagissent très rapidement et favorablement à une monothérapie corticoïde (ce qui est même un argument diagnostic dans la PPR).
Le traitement de l'artérite à cellules géantes est initié avec de la prednisone. Pour l’EULAR et le PNDS, le traitement de première intention reste la corticothérapie seule, débutée entre 40 et 60 mg/j pour l’EULAR, 0,7 à 1 mg/Kg/j en fonction de l’existence de complications ischémiques pour les recommandations françaises. L’EULAR recommande d’atteindre la dose de 5 mg/j à un an, ce qui correspond aux recommandations françaises qui proposent des objectifs semblables : 15 à 20 mg/j à trois mois, 10 mg/j à six mois, 5 mg/j à douze mois puis un sevrage autour de 18 mois. Compte tenu du risque de complications ischémiques irréversibles, les manifestations cliniques de la maladie indiquant une irrigation sanguine instable des yeux ou du système nerveux central (par exemple, neuropathie optique artéritique) sont généralement traitées avec un traitement à forte dose par voie intraveineuse (1000 mg de méthylprednisolone par jour pendant 3 jours consécutifs) afin d'optimiser l'immunosuppression et de supprimer l'œdème tissulaire. En effet, une fois que la nécrose tissulaire s'est produite (ischémie du nerf optique avec cécité pendant plusieurs heures), elle est irréversible.
Sauf contre-indication, il parait raisonnable de prescrire un traitement par aspirine à dose anti-agrégante au cours du premier mois suivant le diagnostic de maladie de Horton et de le prolonger chez les patients qui ont une complication ischémique ou une sténose vasculaire. Cela suppose de réaliser une évaluation exhaustive des atteintes vasculaires au moment du diagnostic de Horton.
Chez la plupart des patients, l'administration de fortes doses de corticoïdes est suivie d'une amélioration rapide des signes inflammatoires systémiques. Dans la pratique, la réduction progressive des corticoïdes est généralement entamée une fois que les signes cliniques ont disparu et que la VS et la CRP se sont normalisées. Selon la British Society for Rheumatology (BSR), la dose est d'abord réduite de 10 à 20% toutes les deux semaines puis, lorsque la dose tombe en dessous de 10 mg de prednisone par jour, la réduction est généralement ralentie (généralement de 1 mg par mois). Les recommandations de la Ligue européenne contre le rhumatisme (EULAR) suggèrent une diminution initiale plus rapide jusqu'à une dose de 10 à 15 mg par jour dans les 3 mois suivant le début du traitement.
Les doses de corticoïdes utilisées pour traiter la pseudo-polyarthrite rhizomélique sont beaucoup plus faibles que celles utilisées pour le traitement de l'artérite à cellules géantes. Chez la majorité des patients, une dose de 15 à 20 mg de prednisone par jour est suffisante pour contrôler les myalgies. Les résultats cliniques doivent être utilisés pour guider une diminution lente des corticoïdes. Les recommandations de la BSR suggèrent l'administration de 10 à 15 mg de prednisolone par jour sur une période d'environ 10 semaines, suivie d'une diminution lente. Les rechutes de myalgies sont fréquentes et nécessitent un ajustement de la dose. Les rechutes répétitives doivent entraîner une réévaluation diagnostique, y compris une évaluation de l'artérite à cellules géantes à part entière et des pathologies non-vascularitiques.
Près de la moitié des patients rechutent lors de la réduction de la corticothérapie
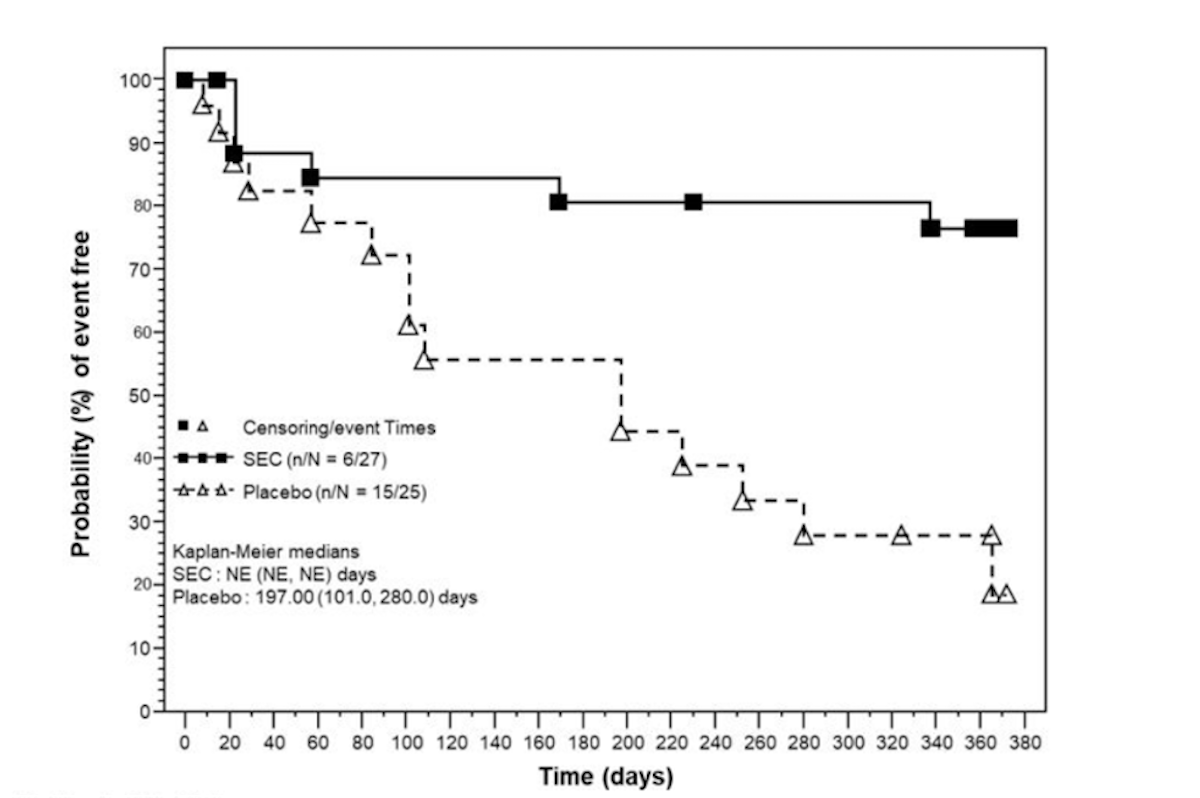
Les rechutes de la maladie chez les patients souffrant d'artérite à cellules géantes et de pseudo-polyarthrite rhizomélique sont fréquentes pendant la réduction progressive des corticoïdes et répondent souvent à une augmentation de 10 à 20% de la dose. Ces rechutes se manifestent rarement par des complications ischémiques. Aucun agent d'épargne glucocorticoïde n'a été approuvé en France pour le traitement de l'artérite à cellules géantes ou de la pseudo-polyarthrite rhizomélique même si plusieurs études font état de l’intérêt de plusieurs biothérapies dans ce contexte dont les anti-IL6.
En cas de rechute d’une maladie de Horton, l’EULAR distingue rechute mineure et rechute majeure, ces dernières étant définies par une rechute accompagnée de signes ischémiques (claudication des mâchoires, signes visuels, ischémie de membre, AVC, apparition ou progression d’une lésion vasculaire à l’imagerie). En cas de rechute mineure, la corticothérapie est majorée à la dose antérieurement efficace. En cas de rechute majeure, la dose est augmentée entre 40 et 60 mg/j. Dans tous les cas, l’instauration d’un traitement d’épargne est recommandée, en première ligne du tocilizumab (anti-IL6) plutôt que du méthotrexate, car il y a plus de données concernant l’efficacité du tocilizumab chez les patients rechuteurs. Ensuite, conformément à ce qui a été étudié dans l’essai GiACTA, la dose de corticoïdes est diminuée avec pour objectif un sevrage en six mois en cas de traitement par tocilizumab.
Les marqueurs inflammatoires sont contrôlés tous les mois pendant la première année de traitement, tous les deux mois pendant l'année suivante et à des intervalles de 3 à 6 mois pendant le suivi à long terme. Des niveaux élevés de VS ou de CRP, sans signes cliniques concomitants, ne doivent pas automatiquement déclencher une intensification substantielle de l'immunosuppression. Certains patients ne s'en sortent pas bien à l'arrêt des corticoïdes, ce qui doit faire envisager une activité continue et latente de la maladie.
Plus de la moitié des patients souffrant de pseudo-polyarthrite rhizomélique ont une rechute lors de la diminution progressive de la corticothérapie. Des traitements d'appoint, dont le méthotrexate, ont été étudiés sans que leur bénéfice ait été clairement démontré. Un anticorps anti-récepteur de l’interleukine-6 a montré une efficacité significative dans l'obtention d'une rémission soutenue et dans la réduction de la dose cumulative de corticoïdes chez les patients souffrant d'une rechute de la pseudo-polyarthrite rhizomélique au cours de la réduction progressive de la corticothérapie.
L'utilisation de corticoïdes nécessite une surveillance attentive des effets indésirables, en particulier lors de l’utilisation prolongée de doses supra-physiologiques (≥5 mg par jour). Au cours d'un suivi de 10 ans d'une cohorte de patients souffrant d'artérite à cellules géantes, plus de 80% d'entre eux ont eu au moins une complication liée au traitement par corticoïdes. Les patients doivent être surveillés pour l'hypertension, l'hyperglycémie et la perte osseuse. Des mesures de protection contre la perte osseuse doivent être mises en place. Une prophylaxie contre la pneumonie à Pneumocystis jirovecii doit être envisagée chez les patients recevant des doses de prednisone de 20 mg ou plus par jour. L'activité physique et, le cas échéant, le traitement efficace aident à maintenir la force musculaire et à minimiser les effets secondaires des corticoïdes. Des efforts doivent être faits pour minimiser la durée du traitement et la dose cumulative de corticoïdes.
Références
Weyand CM, Goronzy JJ. Giant-cell arteritis and polymyalgia rheumatica. N Engl J Med. 2014;371:50-57.
Smetana GW, Shmerling RH. Does this patient have temporal arteritis? JAMA. 2002;287:92-101.
Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet. 2008;372:234-245.
Dejaco C, Singh YP, Perel P, et al. European League Against Rheumatism/American College of Rheumatology recommendations for the management of polymyalgia rheumatica. Ann Rheum Dis. 2015;74:1799-1807.
Gabriel SE, Sunku J, Salvarani C, et al. Adverse outcomes of anti-inflammatory therapy among patients with polymyalgia rheumatica. Arthritis Rheum. 2004;51:144-150.
Caporali R, Cimmino MA, Ferraccioli G, et al. Systemic inflammation in polymyalgia rheumatica is more sensitive to glucocorticoid treatment than in rheumatoid arthritis. J Rheumatol. 2008;35:734-739.
Kermani TA, Warrington KJ. Polymyalgia rheumatica. Lancet. 2013;381:63-72.
Mackie SL, Pease CT, Fukuba E, et al. Whole-body MRI of patients with polymyalgia rheumatica identifies a distinct subset with complete response to corticosteroids. Ann Rheum Dis. 2014;73:2188-2193.
Raheel S, Balaratnasingam C, Jung SR, et al. Temporal arteritis: recent advances and continuing uncertainties. Br J Ophthalmol. 2017;101:1237-1241.
Weyand CM, Liao YJ, Goronzy JJ. The immunopathology of giant-cell arteritis: diagnostic and therapeutic implications. J Neuroophthalmol. 2012;32:259-265.
Lee Y, Seo KW, Kim HL, et al. Polymyalgia rheumatica and giant-cell arteritis: a systematic review. J Rheumatol. 2020;47:1513-1521.
Koster MJ, Warrington KJ. Giant-cell arteritis: pathogenesis, diagnosis, and management. Curr Opin Rheumatol. 2017;29:397-403.
Gabriel SE, O'Fallon WM, Achkar AA, et al. The incidence of giant-cell arteritis and polymyalgia rheumatica in Olmsted County, Minnesota: apparent fluctuations in incidence rates. J Rheumatol. 1995;22:1564-1571.
van der Geest KSM, Sandovici M, Brouwer E, et al. What is the current evidence for disease subsets in giant-cell arteritis